+) semanal 14,15
[Biologia] cap 18. 1-3
microscopicos!! MO DE CAMPO CLARO es un microscopio que utiliza un haz de luz+ un sistema de lentes opticos, para generar imagenes grandes de objetos muy pequenos 광학 렌즈 시스템 인 광선(haz de luz..
celestinalamasdivina.tistory.com
biologia- 18.4 - 18.8
세포배양, 단백질 정제... los primeros investigadores en cultivar celulas empleaban medios que contenian una gran variedad de sustancias desconocidas. 세포를 배양시킨 최초의 연구자들은 알려지지 않은..
celestinalamasdivina.tistory.com
현미경의 종류와 용도
현미경의 종류와 용도 1. 광학현미경 대물렌즈 및 접안렌즈라고 부르는 2조의 렌즈를 조합하여 미소한 물체...
blog.naver.com
[실험실 기초]현미경 종류, 위상차 현미경(Phase contrast microscope)이란?🔬
어느 실험실이든 현미경 없는 실험실은 찾기 힘드실 거예요 특히 이러한 실험과목이 있는 학과 1학년 또는 2학년 때 (생명공학과, 화학과, 의생명학과 등) 꼭 현미경 사용법을 다시 배우는데요
sudol0119.tistory.com
[세포생물학] 2.2 : 형광현미경(fluorescence microscope), 공초점현미경(confocal microscopy), 다광자 현미경(m
이번 포스트에서는 형광현미경, 공초점현미경, 다광자현미경에 대해 알아볼게요. 이들 현미경은 모두 나름의 단점들을 개선하기 위해 만들어진 것이기 때문에, 각각의 스토리도 중요하지만 서
unicellular.tistory.com
1. TEM(투과전자현미경)이란 무엇일까?
오퍼레이터로 자리잡기 위해 공부를 진행해 보고자한다. 아직 기기를 다뤄보지 않은 상태에서 이 지식 저 ...
blog.naver.com
➔ TEM 현미경
+) 참고하면 좋은 원서
다광자 공초점 현미경 기반의 실시간 신경세포 이미징 기술개발
1. 다광자 공초점 현미경 기반의 실시간 신경세포 이미징 시스템 구축- 최신 다광자 공초점 현미경을 도입하여 이를 기반으로 함- 최적화된 배양 유닛을 개발하여 국제적인 수준의 신경세포 이
scienceon.kisti.re.kr
➔ 다광자 현미경
18.1 광학 현미경El microscopio optico
현미경microscopio: 물체의 확대된 이미지를 제공하는 도구
<복합 광학 현미경의 중요한 구성 요소most important components of a compound light microscope>

광원fuente de luz
- 현미경 외부에 존재하거나 바닥몸통base에 있을 수 있음
- 시료muestra 를 밝힌다
집광(콘덴서) 렌즈lente condensadora
- 부재물대subyacente (현미경의 재물대(stage) 밑의 집광렌즈·반사경 및 기타 부품을 받치는 부분)에 존재한다
- 광원에서 확산된 광선을 모으고 (빛을 압축) 확대magnification 후 시료의 아주 작은 부분을 볼 수 있도록 하는 작은 원뿔cono형의 밝은 빛으로 시료를 비쳐준다!
컨덴서는 압축장치란 뜻입니다. 현미경엔 컨덴서 렌즈가 있고 빛을 압축하는 역활을 합니다. 위치는 현미경 따라 다른데 보통은 아래에 큰 빛광원이 있고 이걸 작은 빛 줄기로 압축해 샘플에 내보내주는게 컨덴서 렌즈에요. 큰 램프의 빛은 램프 중앙과 가장자리의 빛 강도가 다른데 이걸 한곳으로 모으면 필드 모든 부분에 일정한 빛 강도를 쓸 수 있게 됩니다.
아이리스 다이아프램이 컨덴서 렌즈에서 나온 빛 위에 위치해 있는 조리개 같은거고 구멍을 키웠다 줄였다를 함으로 전체적인 밝기를 조율해줍니다.
대물렌즈lente del objetivo
- 집광렌즈에 의해 시료에 집중된 광선은 현미경의 대물렌즈를 통해 모여진다
- 두 종류의 광선이 대물렌즈로 들어오게 됨
| 1. 시료가 변경된 것 | 2. 시료가 변경되지 않은것 |
| - 시료의 여러부분에서 발생한다 - 스스로 이미지를 형성한다! |
- 집광기condensador에서 발생한 빛 - 대물렌즈로 직접directly전달되어 시야의 배경광fondo de campo visual을 형성 |
| 대물렌즈가 이 두 광선의 초점을 맞추고, 현미경 내 기둥에서 확대된 물체의 실상imagen real을 형성한당! |
|
접안렌즈lente del ocular
- 대물렌즈를 통해 형성된 상imagen이 여기서 확대된 허상imagen virtual 을 형성한당!
- 제 2 렌즈계라고 부름
인체의 망막retina
- 눈 앞부분에 위치
- 접안렌즈에서 생성된 허상을 이용해서 망막에 실상imagen real을 생성한다!
- 제 3 렌즈계라고 부름

초점나사tornillo de enfoque가 돌아감
=> 시료muestra와 대물렌즈간의 상대적 거리가 변함!
=> 망막 표면에 형성될 이미지가 뚜렷하도록 초점을 잡아줌!
=> 현미경의 최종확대율은 대물렌즈/접안렌즈의 곱이다! The total magnification attained by the microscope is the product of the magnifications produced by the objective lens and the ocular lens.

해상력Resolucion
확대 잘한다고 잘 볼 수 있는거 아님. 이미지는 그 퀄리티가 중요하자나 화질 다 깨진것도 있고...


고배율 대물 렌즈(예: 63 X)와 대물 렌즈의 이미지를 5배 더 확대하는 접안 렌즈(5X)를 사용할때
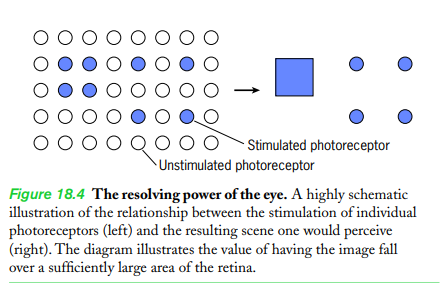
- 범위campo가 염색체로 구성되어 있고, 각각 몇 개인지도 관찰할려고 함
- 근데에에 그 중 일부가 너무 가까이 붙어 있어서 각각 다른 구조라고 구분할 수 없는 상황이다! (그림 18.3a).
이때 어떻게 하는게 좋을까요오오
솔루션 1. 보고 있는 물체의 크기를 늘리기 위해 접안렌즈를 변경한당!
위에서같은 경우면은 5X에서 10X 으로 바꿔주는거야 (그림 18.3b).
=> 대물렌즈에서 생성된 이미지가 망막에서 더 큰 부분으로 볼 수 있게된거지! 뭔가 이거 유튜브볼때 340p랑 4k 비교한다고 생각하면 이해가 빠른듯
더 많은 광수용체가 이미지에 대한 정보를 제공할수록, 더 많은 세세한 부분을 볼 수 있게 됨!
근데 만약에 20X로 바꾸잖아? 의외로 이미지는 커져도 더 많은 정보를 가지지는 않아요 왜냐! 이때의 접안렌즈의 변화는 더 많은, 디테일한 정보를 더 제공하지 않거든!
=> 대물렌즈로 생성된 이미지: 접안렌즈 도수가 더 증가해도 더이상 향상될 만한 것이 없당!
=> 더 많은 망막표면을 차지하더라도 어처피 더 많은 정보를 가지지는 않음
=> 공확대magnificacion vacia: 배율이 의미가 없다(그림 18.3c 참조).
회절difraccion
- 대물렌즈의 광학적 퀄리티optical quality: 미세한 세부사항을 식별discriminated하거나 분해resolved하는 정도를 측정한당!
- 현미경을 통해 얻을 수 있는 해상도를 제한한다
해상력poder de resolucion: 두 점을 식별할 수 있는 능력!
- 회절 한계limited by diffraction: 광학 현미경이 이용하는 가시광선의 파장길이 절반보다 작은 두 물체 간 거리는 일반 광학 렌즈로는 식별할 할 수 없음을 의미
- 시료의 한점에서 나오는emana 빛은 한점으로 보이지 않고 작은 원반으로 보인다
- 두점에서 생성된 원반이 겹치게 되면 이미지를 구분할 수 없게 됨
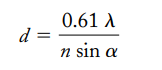
- 광학 파동의 길이longitud de onda 에 의해 제한됨
- d (최소거리): 두 점을 구분하기 위해 분리하는 최소한의 거리 (d 값이 크면 해상력이 나쁜 것이고, d 값이 작으면 해상력이 좋은 것이다)
- λ (광학파동 길이): ex. 백색광의 파동: 527nm
- n (굴절률indice refractivo): 시료와 대물렌즈사이 매질굴절률
- α: 대물렌즈에 들어오는 원뿔빛의 각도 절반, 빛이 모이는 정도를 재며 개수abertura 와 직접적인 연관을 가짐!
- 개구수치 abertura nuemrica (AN): 각 렌즈에 대한 상수로, 빛이 모이는 품질을 계산할 수 있다!
- 공기중의 대물렌즈: α 최대각도 90 의 사인: 1 / 공기굴절률indice refractivo del aire : 1.0 = 최대 AN: 1.0
- 기름에서 사용되는 대물렌즈 AN: 1.5 정도
- 일반적인 광학 현미경에서 사용되는 최대 개구수: 500-1000배 사이!
=> 이것보다 높은 비율이면~~~ 공확대가 발생 => 이미지 품질이 깨짐!
=> 렌즈를 시료 가까이에 배치하는 이유: 초점거리가 짧을수록 높은 개구수를 얻을 수 있음


=> 조명의 최소파장과 최대개구수를 대입: 광학 현미경의 한계해상도limite de resolucion 를 결정함
=> 광학 현미경의 한계해상도limite de resolucion: 0.2µm (200 nm) 보다 작은 값 (핵/ 미토콘드리아같은 큰 세포 소기관을 구별할 수 있다!)
=> 사람의 육안ojo desnudo: 한계해상도 약 0.1mm, 개구수: 0.004정도
- 광학적 결함defecto optico/ 수차aberraciones의 영향도 받는당!
+) 7가지 중요한 수차가 있음
- 렌즈제조사가 이론적한계에 근접한 실제 해상력poder de resolucion real을 가진 대물렌즈를 생산해야함
- 대물렌즈의 수차제거를 위해 하나로 이루어진 렌즈가 아닌, 복잡한 여러렌즈로 만들어진다 (내꺼 도수 높아서 압축하는거 생각해보장)
- 이렇게 여러개로 이루어진 렌즈는 필요한 확대율을 제공/ 수정된 전체이미지를 갖는다!
가시성visibilidad

- 물체를 관찰할수 있도록 하는 현실적 요소
투명유리구슬cuenta 를 보면 뒤에 머가 있든 일단 형태는 나타나니까 선명하게 보일 수 있다
유리구슬에다가 이머젼 오일을 두면? 잘 안보이지 왜냐면 유체랑 투명구슬이랑 구분이 안가거든
대비contraste: 이렇게 가까이에 위치한 물체를 구분할때 필요한 녀석임
별을 예로들자면, 아침이나 저녁이나 하늘의 별은 항상 그 자리에 존재하지만 낮에는 천체cuerpo celeste 가 없는 것 처럼 보임! 별은 시야에서 사라졌지만 하늘에서 사라진 것이 아님. 다만 배경이 더 밝기 때문에 보이지 않는거징!
- 거시적macroscopico으로, 우리는 물체를 비추던 빛이 다시 눈으로 반사되면서 그 빛을 통해 물체를 관찰한다
- 현미경을 사용하면 광원과 눈 사이에 시료를 두고, 물체를 통해 투과되는 빛을 관찰한다 (물체를 회절하는 빛이라고도 함)
=> 물체가 반투명translucido 하면.... 구별이 잘 안되겠지 개구리알처럼.
- 염료로 시료를 염색
- 흡수되지 않는 파장이 눈으로 전달되면서, 물체에 얼룩이coloreado진 것 처럼 보이게 됨
- 서로 다른 염료는 생물학적으로 다른 분자에 결함
- 이를통해 시료의 가시성을 높이고, 세포의 어디에 위치하는지, 무슨물질sustancia이 조직에 존재하는지도 알 수 있음
ex)포일겐 염색tincion de Feulgen
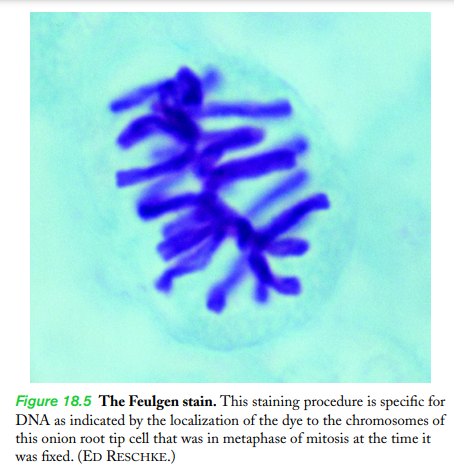
- DNA만을 염색함!
- 현미경에서 염색체 색칠되게 보이도록 한다
- 단점: 이런 염료는 대부분 독성이기에 살아있는 세포에 사용할 수 없음/ 염색하는 과정에서 독성이 생기거나/ 얼룩이 원형질막을 관통하지 않음 => 이 경우 포일겐에서는 염료pigmento를 사용하기 전 조직을 산에서 가수분해한다!
그럼 이제부터 각 현미경의 이름과 특징, 장점 단점, 어떤경우에 뭘 쓸 수 있는지를 알아봅시다아앙
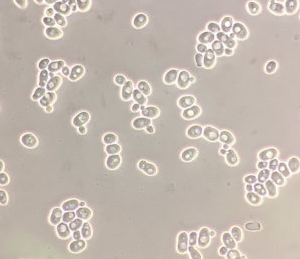
일반광학현미경microscopio de campo brillante (claro)
- 광원으로부터 나오는 빛을 원뿔형 집광렌즈가 빛을 모아서 시료에 조사하면 대물렌즈에서 일차확대상을 만든후 대안렌즈에서 최종 배율(확대된상)을 결정하여 눈으로 관찰할 수 있게된다.
- 이때 시료에서 관찰될때 빛나는 배경이 시료이미지를 대비시킴으로서 관찰 할 수 있게됨
- 조직을 잘라 염색한 것처럼, 대비가 높은 시료를 관찰할때 유용
- 근데 뭐... 다른 시료랑은 그닥 거시성이 좋은편은 아니여. 그래서 필요한게 뭐냐! 준비과정이지!
<일반광학현미경의 준비과정>
| 물체의 전체를 관찰montura completa | 잘라져있는 범위를 관찰montura corte |
| - 죽은생물/살아있는 생물의 온전한intacto 것objeto ex) 원생동물protozoario 나 더 큰 유기체organismo의 작은 부분! |
- 동식물의 조직 대부분은 매우 얆은 조각이거나, 자른체로 조사되지 않는 한 현미경 분석을 하기에 너무 반투명하므로 대부분 조직단면을 자른다corte (시료는 1cm^3 정도로!) 단면corte을 준비하는 과정) 시료를 1cm^3 정도로 체취한 다음 (obtencion) 1- 고정작업fijacion 고정제fijador 이라고 하는 용액에 조직을 담가서inmersion 살아있는 세포를 죽여버림 ( 좋은 고정제일수록 세포막에 빠르게 통과하고 거대분자물질을 못움직이게 함 ex. 폼 알데하이드formaldehido, 알코올alcohol, 아세트산acido acetico 2- 탈수작용dehidratacion 시료의 물기 없애기! 알코올로 조직을 탈수시킴 (transferencia를 거침) 3- 함침impreganacion (삽입해서 고정!) 시료를 단단하게 하는soporte mecanico 단계 파라핀parafina / 왁스인 세라cera: 유기용매solvente organico에 쉽게 용해되므로 함침작업에서 사용됨! 4- 원하는 만큼 자르고corte~~ 5mm 두께의 조각으로 자른당 microtomo / cuchillo de acero를 이용! 5- aclaramiento 함침물질 제거 접착성 파라핀을 포함한 슬라이드laminillas를 벤젠/ 톨루엔tolueno에 담금 => 왁스가 용해disuelve되면 함침물질은 제거되고, 얇은 조직부분은 슬라이드와 결합한 형태로 남게됨 6- 염색하깅montura y tincion 시료를 유리시트에 두고 염색한다 => 효소 / 항체 / 기타 agente 를 이용하여 염색할 수 있음 -Tecnica H&E: hematoxilina, Eosina 이용 (https://blog.naver.com/ldh9765/221786837594) -Tecnica de Feulgen : HCl+reactivo de schiff를 이용, 염색체를 보라색으로 염색  |
<간섭 현미경의 종류>
| 현미경 이름 | 장점 | 단점 |
| 간섭 현미경 microscopio de interferencia  - 물체가 빛을 지연시키는 현상을 이용 - 표본을 투과한 물체광에 광원에서 분리된 간섭광을 겹치게 하여 광파장에 대한 간섭현상으로 투명한 표본에서도 그 구조가 뚜렷이 나타나게하는 원리를 이용 - 물체의 미세구조나 요철의 변화, 위상변화등을 관찰하여 정량측정을 한다 |
 |
|
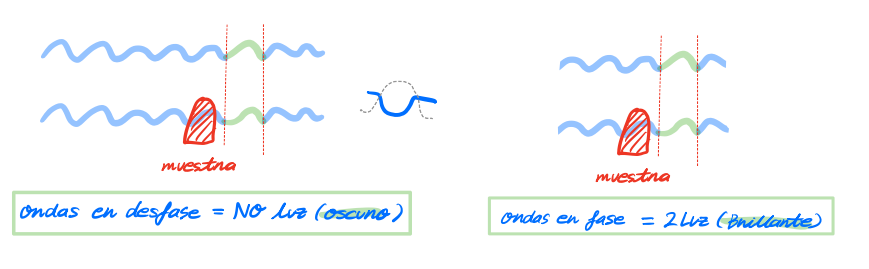
위상차 현미경 (간섭 현미경의 일종) microscopio de contraste de fase  살아있는 세포나 투명한 물체의 경우 명암이나 빛깔의 차이가 아닌 굴절률의 차이를 이용하여 관찰하도록 고안된 현미경이다. 회절된 광선과 회절되지 않은 광선사이에 간섭현상을 일으켜 그 위상차를 명암의 차이로 만들어 물체를 식별하게 만드는 원리! <위상차 현미경의 원리> 1. 시료에서 회절한 후 대물렌즈로 들어오는 직사광선을 나눈다 2. 이 두 광원중 하나의 광선을 간섭interfieran한다 - 그니까 이런 명도는 직사광선이 간섭되서 비쳐지게 되는거임 |
실험실에서 보편적으로 사용되어, 통상적으로도 현미경을 통해 세포를 명확하게 관찰 할 수 있게 되었당 - 시료의 크기가 너무 작거나 (ex: 세포소기관) 염색이 되지 않아 투명한 물체를 관찰할 수 있당 - 특히 살아있는 세포내 구조를 고화질로 조사할 수 있음! (ex. 미토콘드리아, 유사염색체, 액포vacuolas의 역학적 움직임) - 물체의 각 부분이 각기 다른 파동을 가지므로 굴절률indice de refractivo을 비교해야함 - 세포의 DNA나 ~~ RNA나 ~~ 단백질이든 지질이든 탄수화물이든 염이든 물이든 다 다른 비율로 세포소단위를 이루자나. 이말은 즉 각각 굴절율이 다 다르단 말이징. 육안으로는 구별못하지만! 위상차 현미경으로는 이미지의 색상이 진한정도, 즉 명도(밝고/어두운 정도)를 보고 이런 비율을 파악 할 수 있다 이말! |
 - 해상도가 좀 많이 깨지는 편임perdida de resolucion - 굴절률의 급격한subitos차이에 의한 후광현상halos, 그림자로 인해 영향을 받는다ㅠㅠ |
| 미분간섭현미경 (DIC) / 노마스키 간섭 현미경 contraste de interferencia diferencial, interferencia de Nomarski  <미분간섭현미경(DIC)의 원리> - 편광필터를 이용: 일정방향의 빛만 통과한당 - 굴절 프리즘을 통과: 진동/굴절에 의한 빛으로 분리한당 - 시료를 통과하깅 - 굴절 프리즘을 다시한번 통과해서 아까 분리됐던 빛을 하나로 병합 => 간섭효과 발생! 한줄요약: 빛의 간섭현상을 조절해서 3차원 구조로 보이게 함! |
- 위의 위상차 현미경에서 발생한 단점을 해결한다! (해상도 저하, 굴절률의 급격한차이에 의한 후광,음영현상) - 복잡한 빛/프리즘경로를 포함시켜서 직사광선을 완전히 분리하고, 빛을 회절시킴!  - 편광현미경/위상차현미경의 장점을 다 살린 현미경 - 물체의 경계가 확실히 보이니 구분도 잘 될꺼고... - 요즘은 3D 가 대세자나 얘 덕분에 3차원구조로 관찰 가능하댕 특징 - 위상차현미경과의 구조비교: 편광을 만드는 기능필터가 하나 더있냐 없냐의 차이임 - 대비contraste정도: 시료에서의 굴절률변화속도에 따라 달라진다 (가장자리가 잘 드러나게되징!) 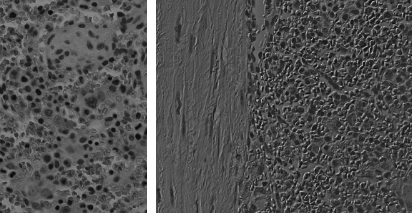 |
공초점 레이저 스캐닝 현미경(CLSM) microscopia confocal de barrido laser

- 레이저의 발전으로 완성된 현미경
- 공초점confocal: 초점이 한 점에서 공유되는 것 , 광원으로 사용하는 레이저/검출기로 사용되는 카메라가 동시에 바라라보는 한점이 존재한다는 것을 의미!
일반광학현미경으로 세포전체 또는 장기의 일부를 관찰하면, 관찰자는 초점 손잡이를 돌려 대물렌즈의 위치를 달리하면서 표본을 관찰.
=> 초점이 맞쳐줬다가 나갔다 한당entran y salen de foco
=> 초점이 달라질 수 있다는 것contener diferentes enfoques은 다시 말하면 그만큼 선명한nitida 이미지를 형성할 수 없다는 말! (왜냐면 시료의 초점평면 위/아래 부분으로 광선interfere이 간섭하기 때문!)
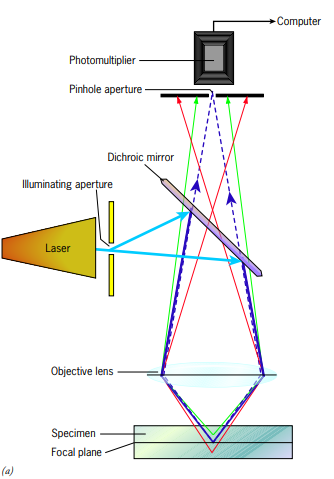

마빈 민스키Marvin Minsky (1950년대 후반 finales del decenio de 1950)
- 공초점confocal 현미경을 개발!
- 두꺼운 표본 내에 얇은평면plano delgado 이미지를 생성함
- 시료의 일정 깊이에서 전체를 빠르게 스캔하는 미세초점 레이저빔이 비출때, 시료 내 얇은평면 (광학단면corte optico)만을 비춘다!
- 형광광학optica fluorescente 도 이 현미경에 이용됨!
1. 단파장longitud de onda corta 입사광이 시료의 형광단에 의해 흡수됨
2. 더 긴 파장longitud de onda mayor으로 다시 방출된다. 이후 핀홀 조리개abertura puntual 한 지점으로 초점이 맞쳐짐enfoca
=> 시료 핀홀abertura/조명면plano iluminado: 공초점이다!
=> 조명면에서 방출된 광선은 조리개abertura를 통과 할 수 있음
=> 평면 위아래plano superior/inferior에서 나오는 광선은 이미지 형성을 못함, 시료의 초점을 벗어난 점은 보이지 않게됨!
<같은 핵을 세가지 다른 평면의 시료에서 관찰했을때!>

=> 초점에서 벗어난 것들은 각 단면이미지에서 잘 드러나지 않음
=> 이런 이미지들을 컴퓨터로 저장almacenar해서 3D로 재구현reconstruir 할 수 있음!
형광현미경 (형광과 관련된 여러 기법) Fluorescence Microscopy (and Related Fluorescence-Based Techniques)

형광현미경The fluorescence microscope
- 관찰자가 형광단florocromos 또는 형광색소floroforos의 위치를 관찰할 수 있다
- 형광fluorescencia: 형광단floroforos이 눈에 보이지 않는 자외선을 흡수해서, 더 긴 가시광선 파장에서 에너지의 일부porciones를 방출하는 것! (특정파장의 빛만 흡수/방출한다!)
- 형광현미경의 광원: 자외선 빔을 생성, 얘네는 형광단에 반응하는 것만 뺀 모든 길이의 파장을 필터에 통과시킨당!
- 단색광monocromatica 광선이 시료에 초점을 맞추면, 형광물질을 가진 시료에서 육안으로 관찰 가능한 가시광선 파장의 빛을 내뿜는다!
- 광원은 자외선 (검은색) 빛만 생성하므로, 시료의 물체는 검정색 배경에서 밝게 표시되어 높은 대비성을 가진다!
<인공형광분자는 분자생물학에서 어떻게 이용될까요~~>
| 기술tecnica, 사진 | 과정/설명 | 사용되는 경우 |
형광면역검정법inmunofluorescencia |
형광단florocromo (ex. 로다민rodamina 나 플루오레세인fluoresceina) 를 항체와 공유결합covanlente (콘쥬게이트conjugado)해서 형광항체anticuerpo fluorescente를 생성하는 방법 단백질형광표지proteina de marca florescencia를 하는거지 결국엔 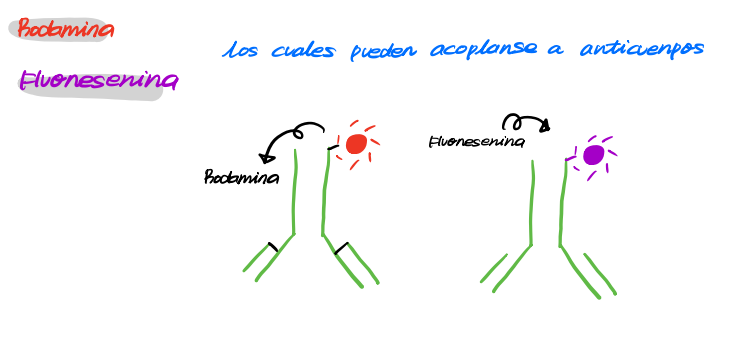 |
얘를 통해 내부 특정단백질의 위치를 알 수 있당! 형광이 어딨니~~소포체에 있었니~~~? |
 |
- 특정 형광단florocromo 이 액틴/튜불린등의 세포단백질과 연결될수 있음 - 형광표지된 단백질을 살아있는 세포에 주입inyectar |
살아있는 세포에서 발생하는 동적 과정 을 연구하는 데 사용 |
 |
DNA/RNA 분자위치를 찾는데situar 이용됨 | |
 |
세포 사이를 통과할 수 있는 분자의 크기를 연구하는 데 사용됨 | |
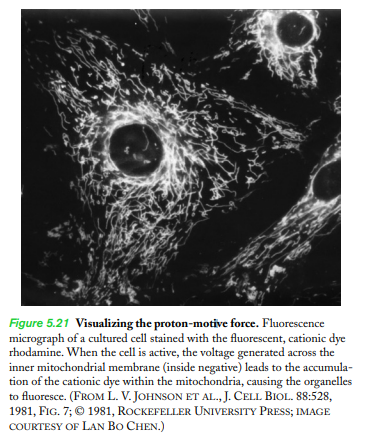 |
막 횡단 전위potencia transmembranarios를 나타내는 지표indicador 막 횡단 전위: 세포막 안쪽과 바깥쪽의 전위차. 신경, 근육 따위의 흥분성 세포에서 나타나는 자극의 수용과 전달을 포함한 모든 생체 전기 현상이 일어나는 원인이 된다 |
|
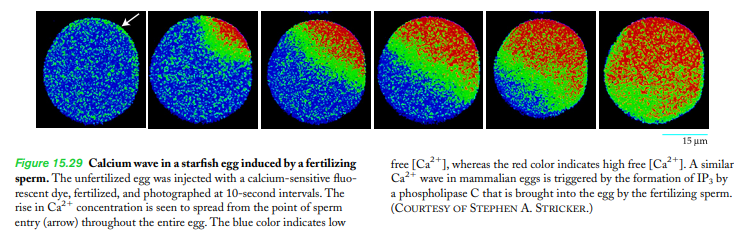 |
세포질의 자유칼슘(Ca+2) 농도를 알기위한 탐색침sonda 으로 이용됨 +) 형광단은 칼슘에 엄청 민감하데, 649p 참고하깅 |
자연산 형광단백질

- 오사무 시모무라Osamu Shimomura : Aequeorea Victoria (크리스탈 해파리medusa de cristal) 종을 발견
- 형광단백질을 정제함! (ex. 에쿼린aequorina, GFP 녹색형광단백질)
- Douglas Prasher, Martin Chalfie: GFP를 암호화하는 유전자를 복제clonar, 질이 유전적으로 결합되어 다른 유기체에서 발현될 수 있는 걸 발견했다.
- GFP를 통해 세포내 분자적 움직임을 관찰 가능
=> GFP 빛을 흡수/내뱉기 위한 다른 보조인자cofactor 가 필요하지 않음
=> 광흡수/방출 발색단cromoforo: GFP 폴리펩타이드의 1차 구조를 구성하는 3개의 아미노산의 자가변형 (촉매 반응에 의해)에 의해 형성됨! 그니까 형광을 담당하는 아미노산은 3개라는거징.
+) GFP는 생체 내에서 칼슘에 의해 활성된 발광단백질(Photoprotein)이나 루시페레이스-옥시루시페린 복합체의 에너지를 운반하는 에너지 전달 수용체로 작용하며, 에쿼린(Aequorin)으로부터 에너지를 받아 508nm의 녹색 형광을 방출하는 2차 형광 단백질로서 작용한다. 세포에 이 GFP를 암호화하고 있는 DNA나 mRNA가 존재할 경우, 이내 GFP 단백질이 세포 내에서 합성되어 강한 형광을 발한다. 발현 정도를 조사하고 싶은 유전자에 GFP를 암호화하는 서열을 연결하면 실제 조사하길 원하는 유전자가 발현하는 장소에서 GFP가 형광을 발현하게 되므로, 유전자의 발현을 조사하는데 많이 사용한다.
<과정>
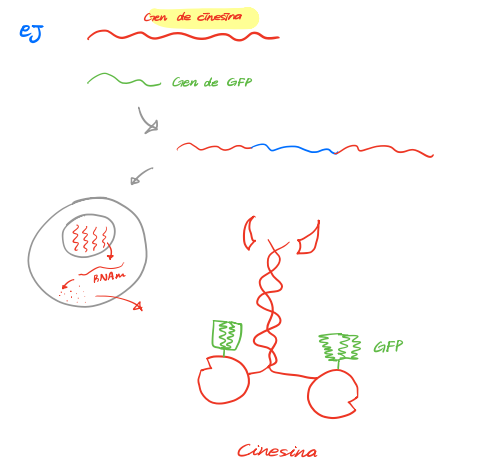
DNA 재조합recombinacion을 이용!
1. 멀쩡한 단백질 하나의 유전자와 + GFP 단백질 하나를 조합시킴quimerizar
2. 그럼 표지된 형광단백질을 얻을 수 있을거 아녀
3. 이걸 인체 안에 넣어가지고 메커니즘을 알 수 있는거징!
< 다양한 색깔의 형광단백질 >
- GFP의 아미노산 일부분의 돌연변이(mutation)에 의해 만들어진다!
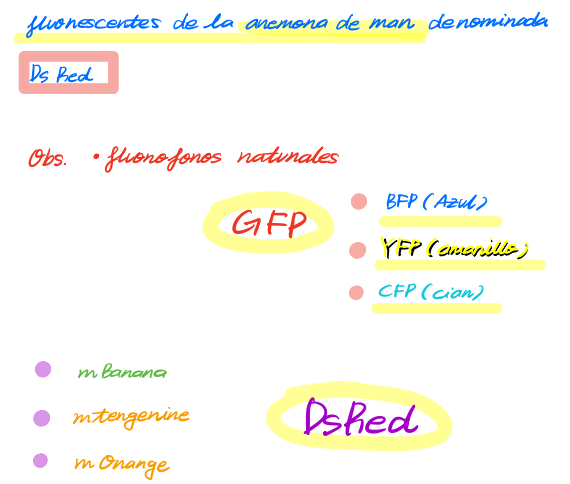
- 파랑이는 BFP
- 노랑이는 YFP
- 청록이는 CFP (시아노에서 온거)
- DsRed
- 말미잘anemona de mar에서 얻은 형광 단백질
- 머 이름보면 알겠지만 빨강색임
- 사량체로 이루어져있당
- 얘를 또 변이시키면 mBanana, mTangerine, and mOrange 등을 얻을 수 있음

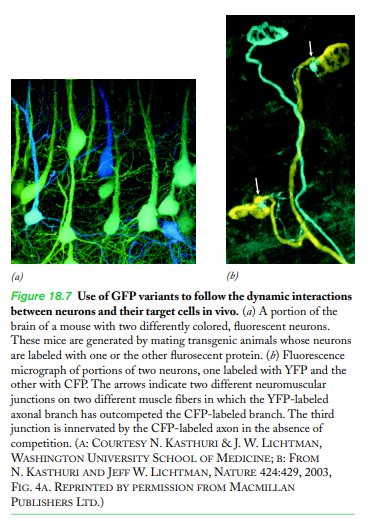
쥐의 뉴런에 다른 색상의 형광 단백질이 포함된 변종을 생성함.
- 근육이 외과적으로 노출되었을 때, 다양한 색상의 뉴런과 신경분포되는 신경근 접합부 사이의 동적 상호작용을 관찰할 수 있다
CFP 색 뉴런의 가지가 근육 조직과의 시냅스 접촉을 위해 YFP 색 뉴런의 가지와 경쟁하는 것을 관찰했습니다.
각각의 경우에 그들은 두 개의 뉴런이 서로 다른 근육 섬유의 신경 분포를 놓고 경쟁할 때 모든 "승리" 가지가 하나의 뉴런에 속하고 모든 "패배" 가지가 다른 뉴런에 속한다는 것을 발견했습니다(그림 18.7b).
장의 시작 현미경 사진은 두 개(또는 그 이상)의 스펙트럼이 다른 형광 단백질을 사용하여 세포 이벤트의 공간적 및 시간적 역학에 대해 얼마나 많이 배울 수 있는지에 대한 또 다른 예를 제공합니다. 이 경우 이중 라벨 전략을 통해 연구자는 단일 세포 소기관의 경계 내에서 발생하는 두 개의 서로 다른 단백질의 동시 움직임을 실시간으로 추적할 수 있습니다. 다른 예는 8장(321페이지)의 실험 경로에 설명되어 있습니다.
Variants of GFP that fluoresce in shades of blue (BFP), yellow (YFP), and cyan (CFP) were generated by Roger Tsien of the University of California, San Diego, through directed mutagenesis of the GFP gene. In addition, a distantly related red fluorescent tetrameric protein (DsRed) has been isolated from a sea anemone. Monomeric variants of DsRed (e.g., mBanana, mTangerine, and mOrange), which fluoresce in a variety of distinguishable colors, have also been generated by mutagenesis experiments in Tsien’s lab. The type of information that can be obtained using this colorful “palette” of GFP variants is illustrated by the study depicted in Figure 18.7, in which researchers generated strains of mice whose neurons contained differently colored fluorescent proteins. When a muscle of one of these mice was exposed surgically, the investigators could observe the dynamic interactions between the variously colored neurons and the neuromuscular junctions being innervated (see Figure 4.56 for a drawing of this type of junction). They watched, for example, as branches from a CFP-colored neuron competed with branches from a YFP-colored neuron for synaptic contact with the muscle tissue. In each case they found that, when two neurons compete for innervation of different muscle fibers, all of the “winning” branches belong to one of the neurons, while all of the “losing” branches belong to the other neuron (Figure 18.7b). The chapter-opening micrographs provide another example of how much can be learned about the spatial and temporal dynamics of cellular events using two (or more) spectrally distinct fluorescent proteins. In this case, the dual-label strategy has allowed investigators to follow the simultaneous movements of two different proteins in real time as they occur within the boundaries of a single cellular organelle. Another example is described in the Experimental Pathway of Chapter 8 (page 321).

| 현미경 이름 | 과정 | 사용되는 경우 |
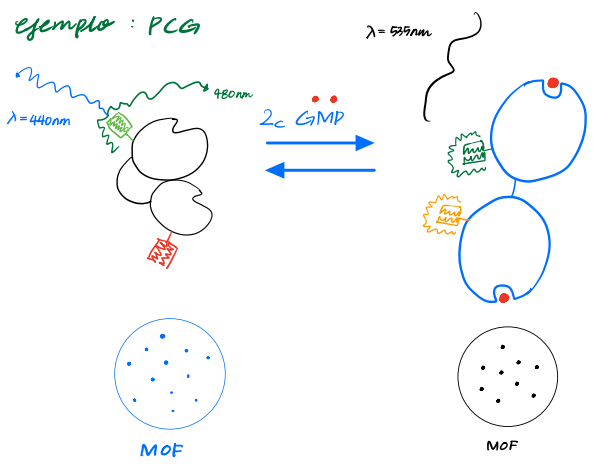
광공명 에너지 전달(FRET)fluorescence resonance energy transfer 에너지 공명resonancia 을 이용해 단백질의 구조적변화cambio conformacional, 단백질끼리의 상호작용interaccion을 관찰할 수 있는 현미경 |
<원리> - 흥분된에너지energia excitada: 1-10nm 사이의 매우 근접한 형광군(기부체donador)에게서 다른 형광군(수용체receptor)에게 전달transferir 될 수 있음 => 주는얘는 형광이 빛나는 정도intensidad가 줄어들겠지? 당연히 받는 얘 (수용체)는 intensidad 이 더 증가할테니 밝게 빛나겠넹 => 이런 원리덕분에 거리안에서 어떻게 두 지점이 변화하는지, 변화하는 정도를 관찰할 수 있겠지! - 나노 규모 범위(1-10nm) 에서 형광단 사이의 거리를 측정할 수 있다 - 단백질의 두 부분 사이(or 두 개의 개별 단백질 사이)의 거리 변화를 측정하는 데 사용됨 - 살아있는 세포에서 관찰 가능 |
- 단백질의 구조적변화cambio conformacional - 단백질끼리의 상호작용interaccion을 알고 싶을때! ex) 예전에 그 cGMP,,,, PKG 관찰 했던거 기억나나용 그게 아마 수용체 배우면서 배우던 부분일껄 여튼 여기서 이제 에너지 변환이 일어나거든 그걸 관찰할 수 있뎅.  GFP 변이체(ECFP/EYFP)가 cGMP-의존성 단백질 키나제(PKG)의 두 가지 다른 부분에 공유적으로 연결되어 있다. - 결합된 cGMP가 없는 경우 두 형광단은 에너지 전달이 일어나기에는 너무 멀리 떨어져 있음. - cGMP의 결합: 두 형광단을 FRET가 발생할 만큼 가까운 거리로 구조적 변화를 유도 이외에도 - 단백질접힘 - 막 내 구성 요소의 결합과 분해(해리) 등 여러과정을 관찰 할 수 있당 - 세포골격에서는 탈린talina 에 의한 활성화 후 인테그린 소단위체의 세포질 꼬리 분리도 관찰할 수 있당! - 신경전달물질이 표면수용체와 결합한 후 cAMP 가 변하는 것도 관찰 가능해용 |
비디오 현미경 및 이미지 처리microscopia por video y procesamiento de imagen  |
 <limite resolutivo: 25nm> 말그대로 21세기 답게 비디오촬영도 하고 그런 이미지들을 컴퓨터를 통해 분류해내는 작업이 가능한 현미경! 현미경+비디오+컴퓨터! 만약에 하나하나 사람이 직접manual분석한다? - 번거롭고tediosa 시간이 오래 걸림lenta - 사람은 주관적sujetivas 이고 편견sesgo을 가지니까 분석에서 오류가 생기기도 하지. 그니까 다 컴퓨터한테 맡기는게 낮당. <원리> - 전자기기를 이용해서/비디오카메라로 녹화하면서 관찰하는것 비디오카메라 - 전하결합장치charge-coupled device, CCD : 빛에 매우 민감하여 매우 어두운 곳에서도 표본을 이미지화 할 수 있당! -> 살아있는 시료를 관찰할때 매우 유용함 (ex. 광원열에 쉽게 손상desvanece 되는 in vivo specimen/ 빛에 노출되면 빠르게 퇴색하는 형광염색표본을 관찰할때 등) - 표본 내에서 아주 작은 대비contraste차를 감지, 증폭하여 아주 작은 물체를 볼 수 있다 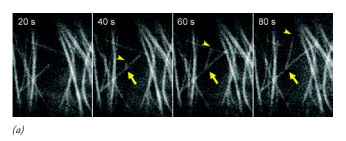 +) 이런 이미지는 디지털이미지로 쉽게 변환됨! 디지털이미지: - 각 부위의 색상/밝기 값을 갖는 개별픽셀pixel 로 이루어져있징 - 컴퓨터파일로 각 이미지가 저장되서, 컴퓨터 처리를 거치면 더 다양한 정보를 가지게됨! - 초점 안맞는 배경을 컴퓨터로 제거시킬수도 있고~~ => 이러면 이미지 선명도가 크게 높아짐 => 밝기 차이=> 색상의 차이로 바껴서 눈에 훨씬 더 분명하게 보인당! |
- 엄청난 이미지를 생성하고, 특징적으로 그것들을 전부 분류할 수 있다 ex) 다양한 siRNA 의 형질fenotipo을 알아내기 위한 도서관처럼 이용할 수 있징! 원하는 정보 꺼내보고~~~ - 세포작용과정에서 단백질을 코딩codificar하는 유전자를 찾을 수 있징!
|
다광자 현미경microscopia multifotonica 에너지가 약한 여러 광자fotones를 시료로 관찰함으로서 시료가 상하지 않도록 조심조심~~하는 현미경임 |
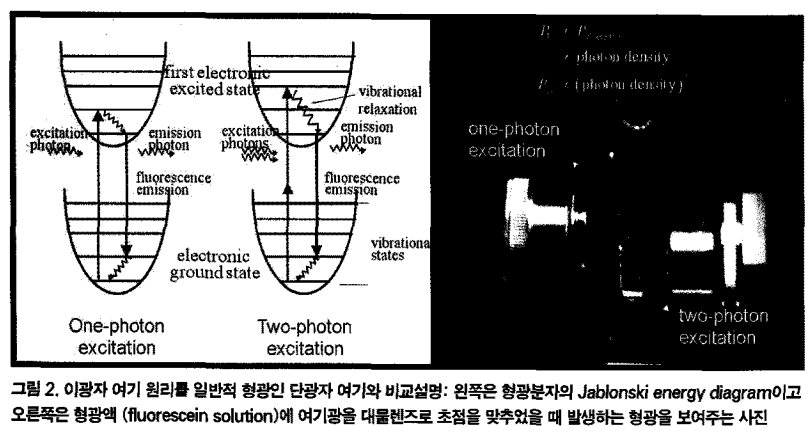 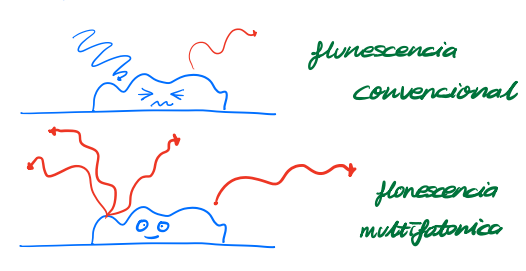 - 체내 형광단이 동시적으로 파장이 더 긴 두개 이상의 광자fotones가 도착하면서 흥분excitada하게 됨! - 광자foton의 파장이 길수록 에너지는 줄어들고, 투과력capacidad de penetracion은 증가한다 =>세포/흡수하는 형광단에 덜 파괴력이 줄어들게된다. 음...그니까 유해하게 하지도 않으면서 더 안쪽에 있는 세포를 관찰할 수 있다는 거징 |
- in vivo deep tissue imaging :살아있는 조직내 최소 200µm 깊이에 존재하는 형광단백질의 움직임도 추적rastrear 가능! ex) 형광표지된 면역세포celulas inmunitarias가 제거extirpado된 림프절ganglio linfatico내에서 이동하는 것도 관찰 할 수 있음  |
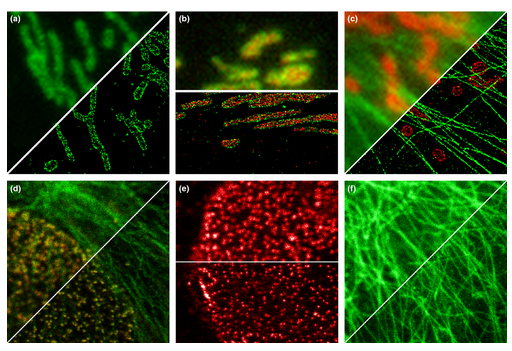
초고해상도 현미경microscopia de superresolucion 위에 저 그림으로 비교하는거지 형광현미경이랑...초해상도기술을 이용한 그림...비교도 안됨... - 초해상도super resolucion: 가장 최근 기술을 이용한 형광현미경 - 빛의 회절에 의한 광학현미경 분해능한계limite de resolucion: 약 200nm (20마이크로미터!) 그래서... 이 분해능 환계를 십 나노미터 단위로 한번 줄여보자!! |
<원리> PA-GFP: - GFP의 특정 폴리펩타이드를 변이시켜서, 광활성화fotoactivable 가능한 분자로 바꾼것 - 비활성화상태를 유지하다가, 보라색 빛luz violeta에 의해 활성화됨 광전환단백질fotoconmutables: - 광파pulsos luminosos를 통해어떤 특정한 파장에서 형광 방출을 껐다켰다activarse o desactivarse 할 수 있음 대표적인 기술 하나를 살펴봅시당 확률적 광학 재구성 현미경Stochastic Optical Reconstruction Microscopy (STORM)기술 - 2014 년 노벨상을 수상한 3가지 초해상도 기술 중 하나 - PALM (photoactivated localization microscopy)이라고도 한다 - 이 기술을 이용해 무려 20nm 미만의 - 광전환 기술의 사용
|
+) 비교본 확대.

a) A conventional fluorescence micrograph of a portion of a cultured mammalian cell with microtubules labeled in green and clathrin-coated pits in red. At this high level of magnification, the image appears pixelated. Moreover, the overlap between the two fluorescent labels produces an orange color, which suggests that the two structures are interconnected. a) 녹색으로 표지된 미세소관과 빨간색으로 클라트린 코팅된 구덩이가 있는 배양된 포유동물 세포의 일부에 대한 기존의 형광 현미경 사진. 이 높은 배율에서 이미지는 픽셀화되어 나타납니다. 더욱이, 두 개의 형광 라벨 사이의 겹침은 두 구조가 상호 연결되어 있음을 시사하는 주황색을 생성합니다.
(b) A STORM super-resolution micrograph of a similar field showing the microtubules and clathrin-coated pits clearly resolved and spatially separated from one another. (b) 미세소관과 클라트린으로 코팅된 구덩이가 명확하게 분리되고 서로 공간적으로 분리되어 있음을 보여주는 유사한 필드의 STORM 초해상도 현미경 사진.
c) A magnified view of a portion of part b c) b 부분의 확대도
18.2 투과 전자 현미경Transmission Electron Microscopy
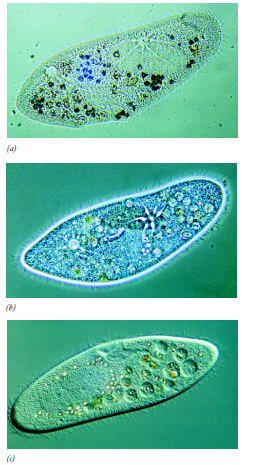
<전자현미경>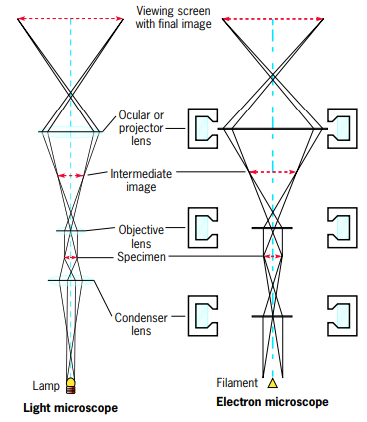 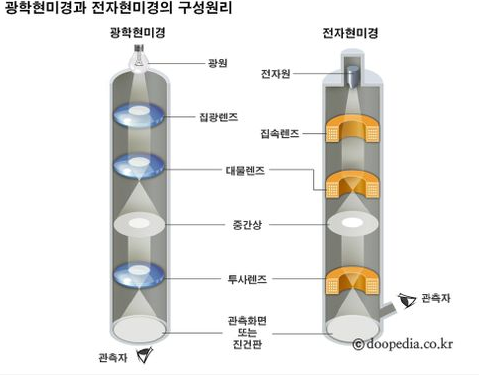 광학현미경과 전자현미경의 렌즈계 비교 <구조> - 전자선rayo de electrones이 통과하는 크고 속이 빈 원통형 기둥columna alta, cilindrica y hueca로 이루어져있음 - 콘솔consola:기둥의 작동operacion de la columna을 전자적으로 제어하는 다이얼 패널panal con disco이 포함됨 - 음극catodo: 기둥의 맨 윗쪽에, 전자원fuente de electrones 을 제공하기 위해서 가열되는 텅스텐tungsteno 와이어alambre 필라멘트! <원리> 가열된 필라멘트에서 전자를 끌어내고, 음극/양극사이에서 고전압에 의해 메우 얇은 빔으로 가속됨 공기는 기둥밖에서 펌핑되서, 전자가 이동하는 진공상태vacio로 만들어준다! 공기가 제거되지 않으면? 가스분자 충돌에 의해 전자가 일찍 퍼지dispersar게 됨ㅠㅠㅠ 광학현미경: 빔이 연마유리렌즈lente de vidrio pulido에 모임enfocar 전자현미경: 음전하의 전자선이 기둥 벽에 있는 전자기렌즈lente electromagneticas에 모이게 됨! 자석의 힘fuerza de los magnetos: 전류에 의해 제어된당 (콘솔consola의 다이얼disco 위치로!) 전자현미경 콘덴서: 전자원/시료사이에 있음, 전자선을 시료에 집중시킨다! 시료: 핀셋pinza으로작고 얇은 금속 격자판pequena rejilla de metal (직경 3mm) 로 고정시켜야 함sujetador 이 홀더는 현미경 기둥에 들어가게 됨se inserta 전자 현미경은 일상에서 볼 수 있는 양자 역학의 산물이라고 할 수 있는데, 전자 현미경이 가용한 이유 자체가 물질파 이론에 의해 전자가 파동성을 갖기 때문이다. 이 전자 간 격차는 당연히 기존 광학 현미경에 사용되는 가시광선 파장보다 매우 짧기 때문에 좋은 전자 현미경의 경우 원자까지 보는 것이 가능하다. 다만 관찰을 위해 세포를 무조건 "고정"시켜야 하는, 달리 말하자면 죽은 세포만 관찰 가능한 단점이 있다. 일반적으로는 세포를 살아있는 상태 그대로 관찰 가능한 광학 현미경에 비해 큰 단점. |
|
| 투과 전자 현미경microscopios electronicos de transmision (TEM)  |
주사 전자 현미경microscopios electronicos de barrido (SEM) |
| https://blog.naver.com/natsuuki/222501234326 - 시료를 통과하는 전자들로 이미지를 형성함 - 전자 파동ondas 덕에 광학현미경보다 훨씬 고해상도의 이미지를 가진다  - 파장이 훨씬 더 짧은 전자선을 이용해서 해상력이 증가한당\ - 전자의 파장: 입자의 이동속도에 따라! => 전압가속도에 따라 달라진다는 말 !  λ: Å단위의 파장 (1Å=0.1nm) V: 볼트단위의 전압voltaje 가속도 전압voltaje : 10.000~100.000V ! (일반적으로는 60.000v) 한 전자의 파장은 0.05Å정도임 (= 광학현미경: 약 0.05Å) - 전자초점렌즈의 심각한 구면수차aberracion esferia 때문에 실제로는 이론상 한계보다 약 100배 작음 => 렌즈의 개구수차를 매우 작게 만들어야 함 (일반적으로 0.01에서 0.001 사이). => 표준 TEM의 실제 분해능 한계는 3 ~ 5 Å => 세포 구조를 관찰할 때 실제 한계는 일반적으로 10~15Å - 초점길이longitudes focales: 전류에 따라 달라짐 => 전류를 잘만 바꿔주면하면 배율이 1000에서 250000배까지 확대 가능! - 대물렌즈: 모든 확대스펙트럼espectro de magnificacion 에 도달함 (100배 정도확대 가능하지만, 광학현미경과는 달리 10000배로 디테일하게 늘릴 수 있음) 1. 시료를 통과한 전자는 기둥 몸통base 에 있는 형광판pantalla fosforescente에 모이게 됨 2. 판에 부딪힌golpean 전자: 형광크리스탈 표면cubierta을 흥분excitan 시키고, 이렇게되면 가시광선을 내보내면서 우리눈에 시료의 이미지를 전달하게 되는거임! <전자현미경의 이미지 형성> - 시료에 수평한 전자빔을 조사하고 시료의 각 부분에 다다른 전자들의 산란차dispercion diferencial를 이용하여 영상에 활용함! (ex. 필라멘트에서 방출된 전자선이 스크린에 모일때, 만약 이 기둥에 스크린이 없으면 균일하게 밝은 이미지를 생성imagen brillante uniforme 한당 만약 근데 이 경로에 시료를 두면! 몇몇 전자는 시료의 원자에 부딪히고 이게 퍼지게dispersar됨. 이때 시료에서 튕겨나가는rebotan 전자는 크기가 작은조리개abertura를 통과할 수 읍어. 그럼 뭐다? 초점면plano focal 그니까 대물렌즈에 도달도 안할 꺼고 그니까 이미지 형성에 관여할 수 읍는거지) => 시료에서 전자의 산란dispersion: 시료를 이루는 원자핵의 크기에 따라서 달라지게 된다는거! 세포에는 불용성물질의 원자가 존재하거든? 뭐냐면 탄소, 산소, 질소, 수소 같는 것들이양. 이런 생물학적 물질은 전자를 산란시키는 능력이 태생적으로 읍어capacidad intrinseca => 물질을 잘 볼 수 있는 대조conctraste를 만들기 위해서 인체조직을 중금속metal pesado 용액으로 고정되고/ 염색하게 됑. 그렇게 되면 이게 전자를 산란시킬 수도 있는거징! 이때 이 금속들은 세포구조를 통과하고, 소기관 여러부분에 선택적으로 복합체complejos를 만들게되징 세포가 금속원자의 많은부분에 결합하면, 출입하는 전자의 수를 줄이게 됑! 판의 일정부분에 적은 전자가 모이게 되면, 어두어지게된당! 전자가 (판을 없엔다음)판 아래 이미지판에 부딪히게 함! => 시료 두께/밀도차에 따른 명암contraste상! - 사진유제emulcionmes fotograficas (https://blog.naver.com/carkor/221215403188 ): 빛같은 전자에 민감해. 빛에 노출되면 사진 인화되는데 흔적이 남그든! 그래서 그 대신 CCD 비디오로 촬영을 하게 돼. <CCD의 장단점> - 장점:화학적인 과정없이 바로! 사진을 남길 수 있음instantanea - 단점: 필름에서 보는 것 처럼 높은 해상도가 아니랭. => 필름에서 얻은 이미지는 디지털작업digitalizacion을 통해 디지털이미지로 변환 시킬수도 있지롱~~ - 광선과 전자기 렌즈lentes electromagnetico (bobibas) 를 이용하는 현미경 - 죽은!!! tejido조직, eucariota, procariota 세포를 관찰가능 - bobina objetivo , bobina proyectora 가 lente objetivo 와 ocular를 대신한다. - d real = 10A, d practico 3 A-> 작은 개구수의 덕분! - 한계해상도: 파장의 길이를 바꾸면 바꾼다! (예, 색을 바꾸기) - voltaje 전압: 10.000~100.000! (일반적으로는 60.000v) - 준비과정 필요! |
- 시료표면에서 튕겨나간rebotan 전자를 사용함 |
<준비과정!>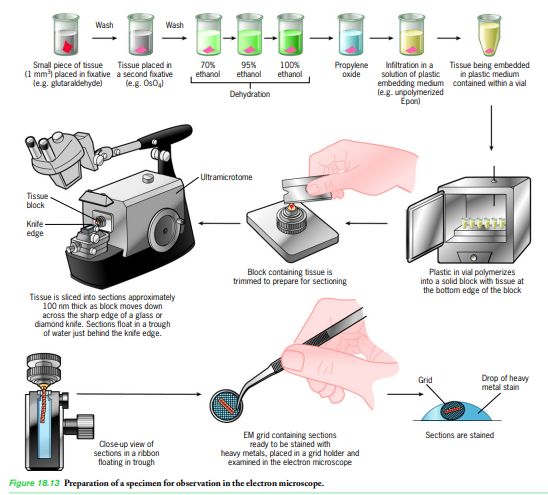 a obtencion b fijacion (glutaraldehido 단백질 끼리의 결합부분, OsOH 지질을 고정) +) - 광학현미경보다 더 조밀한 조사escrutinio가 필요하므로 엄청 중요한 과정임 - 구조에 영향이 가지 않게 좋은 고정제를 이용해 세포를 죽인당suspender la vida! - 한...1세제곱밀리미터 (1mm^3) 정도로 조직을 자른다음 함침impregar시켜! - 고정제fijadores: 고정제는 세포 거대분자macromoleculas를 변성desnaturalizar 및 침전precipitar시키는 화학 물질! => 이 과정에서 인공물artefacto: 살아있는 세포에는 없는 물질을 응고/침전시켜서 생기는 일종의 찌꺼기?가 생길 수 있음 (그래서 응 만약에 새로운 물질 발견했는데 이게 인공물일지도 모르자나 그러면 고정제 없이살펴보거나 이제 살아있는거랑 비교해서 이게 있던건지 아님 생긴 찌꺼긴지 살펴봐야됑. 귀찮구만) <고정제 없이 조직을 보는 방법!> 1. 급속동결congela con rapidez 2. 다양한 특수기술을 이용! 대표적인 전자현미경 고정제: 글루타르알데히드glutaraldehido, 사산화오스뮴tetroxido de osmio - 글루타르알데히드: 분자의 양쪽 끝에 알데히드기가 있는 5-탄소 화합물. - 알데히드기: 단백질의 아미노기와 반응, 단백질끼리 교차결합을 만들어서,불용성insoluble 그물망 만듦로 가교시킵니다. - 오스뮴osmio: 주로 지방산과 반응하여, 세포막을 보존하는 중금속metal pesado! C deshidratacion con etanol(알코올)... (조직공간espacio histico: 단면이 잘 잘려나갈수 있게하는 물질로 채워짐) 세라(왁스)로 자를때 - 광학현미경: 5마이크로미터정도 - 전자현미경: 0.1마이크로미터(=리보솜 4개의 굵기grosor) 보다 작은게 낫당! d aclaramiento:에탄올을 oxido de propileno로 지운다! e impregnacion함침: 시료를 단단하게 함 polimerizacion de resinas epoxicas, polimerizacion de resinas acrilicas 를 이용! 에폭시 수지, 아크릴 수지중합화 (ex. 1,4-butanediol diglicidil이랑 다른거) +) 금속/여러 다른 물질로 표지된 항체를 조직단면에 이용할수도 있당. 이럴려먼 함침할때 항상 아크릴수지로 해야해. 이게 에폭시수지보다는 투과성permeable이 좋거등. f corte! 울트라 마이크로톰, 유리 칼vidrio이나 다이아몬드 칼hoja de diamante finamente pulido을 이용하며 시료를 100nm로 자른다 이렇게 잘라진 단면은 칼navaja 끝부분 아래에서 물의 표면에 떠다니게됑 g tincion y montura: 금속 격자판rejilla metalica에 시료를 올리고 염색! ->중금속 (ex. acetato de uranilo, citratro de plomo) 을 이용 +) 중금속 원자가 거대분자랑 결합해서, 전자선 산란이 일어날 만큼의 원자적 밀도를 갖게 하징 -> 전자가 통과하는 것을 막는다! <tem 투과전자현미경 을 위한 특별한 과정!> -coloracion negativa:다 분자 복합체 또는 바이러스와 같은 입자를 위해! 샘플은 대비에 의존하지 않음 ->주변을 색칠하기 때문에! -그림자 모델: 입자를 위한 과정 음영과정은 진공상태에서 platino를 통해 이루어진다 -criofractura: mp, centrioles와 같은 여러 복잡한 단계 가있는 구조물 위해 쓰이는 기술
|
|
동결고정criofijacion, 동결된시료의 사용


- 고정/함침과정을 생략할 수 있는 방법!: 조직을 빠르게 얼려버리는거징
- 동결고정criofijacion: 거대분자 구조를 바꾸지 않고, 인공물artefacto생성을 막는 거징!
- 얼음결정형성formacion de cristales de hielo:
- 핵이 형성되는곳의 바깥쪽에서부터 생김
- 세포를 이루는 약한구조fragil contenido를 부셔버림
- 결정이 형성되기도 전에 얼려버리면 되지렁>< ( like 물의 유리화vitrificada상태:물이 어는데~ 액체상태는 유지하는 것처럼'~~~ )
- 작은 시료: 프로판propano(끓는점:-42도) 같은 엄청 차가운액체에다가 시료를 담군당
- 크기가 큰 시료: 엄청난 압력presion을 이용! (ex. 높은수압presion hidrostaticas,액체질소chorros de nitrogeno liquido를 분사se rocia => 얼음결정의 형성속도를 낮쳐줌)
- 파라핀.플라스틱 조직을 이용한 단편이랑 똑같이 특수 마이크로톰microtomo으로 절단 가능
=> 광학/전자현미경 조사 모두에서 사용 가능!
장점:
- 효소같은거는 화학고정제를 사용하면 활성에서 문제가 생길수 있거등. 변성되면서denaturalizacion. 그래서 이럴때 사용하기가 참 조아
- 플라스틱 단편보다 훨씬 준비하는 과정이 빨라요! (ex. 수술중 제거extirpado된 조직의 미세한 구조를 알고싶다? 병리학자들이 그 자리에서 즉석으로 검사할 수 있는거징! 악성종양tumor maligno이 맞는지 아닌지를 수술대mesa de operacion에서 바로알 수 있음!)
- 단면화 필요 ㄴㄴ


극저온 전자 단층 촬영 기술(cryo-ET)tomografia crioelectronica

- 볼프강 바우마이스터wolfgang Baumeister 가 개발한 기술!
- 급속동결되기 직전, 전자 현미경 격자의 표면을 스캔arrastrar해서 손상되지 않은 세포의 얇은 주변 영역의 이미지
- 일반 전자현미경과는 달리 카메라로 직접 찍은게 아닌 컴퓨터에 의해 생성되었기 때문에 3차원성을 가진당!
- 표본이 전자선 축 일정각도로 기울어질때마다, 엄청난양의 2차원 디지털 이미지캡쳐본을 마구마구 정렬alinea함!
- 단층촬영tomograma: 3차원 컴퓨터화 재구성
- 나노크기의 고정되지않고, 완전히 수화hidratadas된 세포를 급속냉동함!
- 시험관 내 3차원 구조를 주사하는데 사용 가능!

- 세포번역traduccion에서 분리된 폴리솜의 재구성reconstruccion 3차원 구조를 조사하는 데 사용됨.
- 무려 일의 자리 나노미터(nm) 해상력resolucion을 가짐!
=> 세포/분자단위에서 엄청 중요하당!!!

+)
<다른 동결된 시료의 전자현미경 분석>
1. 동결할단복제법freeze fracture replication, replicacion por criofactura
2. 단일입자분석single particle analysis, analisis de particulas individuales
음성 염색법Tincion nagativa/coloracion negativa

- 바이러스/리보솜/다중소단위체multipies subunidades 효소/ 세포골격물질/ 단백질 복합체 등등의 매우 작은 물질을 조사할때 사용되는 기술
- 개별단백질proteinas individuales/핵산acido nucleicos의 모양이 주변과 충분히 대비되도록 만듦. 즉, 입자가 아니라 그 주변을 엽색시켜버리는 거지~~~
- 그림처럼 중금속 침전물(ex. 그림에서는 텅스토인산fosfotungstato)을 시료격자rejilla 모든부위에 칠해버림!
- 상대적으로 시료는 밝게 보이쥬~~~?
증영법Modelo de sombra


- 분리된 입자를 관찰하기 위해 물체를 그림자에 둔다proyectar
- 시료를 포함하는 격자rejillas를 밀봉sellada 된 카메라안에 두기!
- 카메라:중금속으로 이루어진 필라멘트(대부분 백금platino을 사용!)랑 탄소를 가짐
- 이 필라멘트는 높은 온도에서 가열되고, 증발evaporar 된 다음 금속덮개를 증착deposita (진공 상태에서 금속이나 화합물 따위를 가열ㆍ증발시켜 그 증기를 물체 표면에 얇은 막으로 입히는 일) 시킨당!
- 입자표면이랑 격자rejilla공간은 그림자 밑에 막cubierta 없이 남게됨!
격자를 전자현미경으로 볼때:
- 그림자부분은 스크린에서 밝게보인당!
- 반대로 증착된 금속 막 부분은 어둡게 보임
=>이미지 스크린 placa fotografica에서 반전됨se invierte

- 반전해서 음성이미지를 만들기 => 입자(금속막)를 밝은 백색광luz blanca brillante로 비쳐줌!
- 입자의 그림자는 어둡게!
=> 떨어져있는 물질에게서 완전한 대비를 나타내고, 3D효과를 보여줌!
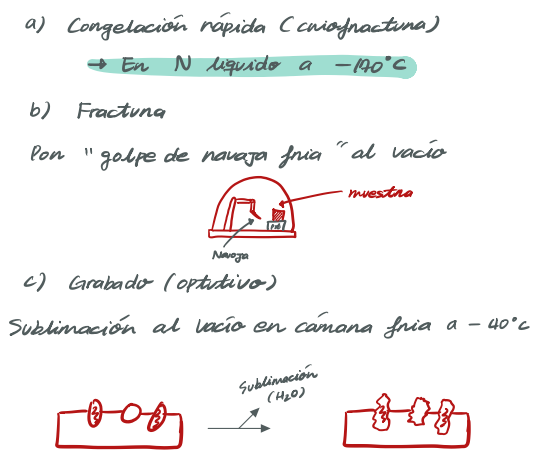
+) 동결할단복제법replicacion por criofactura
1. 조직의 일부분을 작은 금속디스크에 놓고 엄청빠른 속도로 얼려버림
2. 진공 카메라 안의 냉각 스크린위에 디스크를 끼워둔 다음se monta
3. 얼려진 조직을부분을 칼날로 잘라버림!
=> 결국 응 두 조각dos piezas으로 나뉘게 될텐데, 그럼 응 세포소기관은 어캐될까아아ㅏㅇ??
4. 위쪽/ 아래쪽의 편차desviacion 를 일으켜서, 통과한 원형질의 윤곽채contronos del protoplasma atravezado를 반영하는 골절면의 융기elevacion(높게 일어나 들뜸), 함몰(구멍으로 움푹 파인곳)depresion 깊게 파인 골격cresta을 일으킴
=>할단fractura에 의해 노출된expuesta 표면: 세포 내용물에 대한 여러 정보를 가짐!
이걸 어떻게 눈으로 확인할까??
- 복제를 하면 돼용! 왜냐면 복제는
1. 할단된 표면을 중금속막capa 몰드molde 처럼 사용할수 있거등
2. 중금속은 동결되어 (카메라가 할당된 곳의) 노출된 조직 할단표면을 증착deposita하고,
. 목표는 이 정보를 가시화하는 것입니다. 복제 프로세스는 중금속 층이 증착되는 템플릿으로 파손된 표면을 사용하여 이를 수행합니다. 중금속은 조직이 골절된 동일한 챔버에서 동결된 조직의 새로 노출된 표면에 침착됩니다
금속: 그림자를 제공하기 위해 비스듬히 증착됨!
이후 탄소 층: 금속 층 위에 증착되어 금속 패치를 단단한 표면에 접착한당.
이 캐스트가 만들어지면 템플릿을 제공한 조직을 해동하고 제거하고 폐기할 수 있습니다. 그것은 표본 격자에 놓고 전자 현미경으로 보는 금속-탄소 복제물입니다. 복제품의 다른 부분에서 금속 두께의 변화는 관찰 화면에 도달하는 투과 전자의 수의 변화를 일으켜 이미지에 필요한 대비를 생성합니다. 4장에서 논의된 바와 같이, 골절 계획은 종종 세포막의 중심을 통과하는 동결 블록을 통해 저항이 가장 적은 경로를 취합니다. 결과적으로, 이 기술은 지질 이중층(그림 4.15, 7.30, 7.31 및 7.32에서와 같이)에 걸쳐 있기 때문에 통합 막 단백질의 분포를 조사하는 데 특히 적합합니다. Daniel Branton과 다른 사람들에 의해 수행된 이러한 연구는 1970년대 초 세포막의 유체 모자이크 구조 형성에 중요한 역할을 했습니다(124페이지).
Freeze-Fracture Replication and Freeze Etching As noted above, a number of electron microscopic techniques have been adapted to work with frozen tissues. The ultrastructure of frozen cells is often viewed using the technique of freezefracture replication, which is illustrated in Figure 18.16. Small pieces of tissue are placed on a small metal disk and rapidly frozen. The disk is then mounted on a cooled stage within a vacuum chamber, and the frozen tissue block is struck by a knife edge. The resulting fracture plane spreads out from the point of contact, splitting the tissue into two pieces, not unlike the way that an axe blade splits a piece of wood in two. Consider what might happen as a fracture plane spreads through a cell containing a variety of organelles of different composition. These structures tend to cause deviations in the fracture plane, either upward or downward, giving the fracture face elevations, depressions, and ridges that reflect the contours of the protoplasm traversed. Consequently, the surfaces exposed by the fracture contain information about the contents of the cell. The goal is to make this information visible. The replication process accomplishes this by using the fractured surface as a template on which a heavy-metal layer is deposited. The heavy metal is deposited onto the newly exposed surface of the frozen tissue in the same chamber where the tissue was fractured. The metal is deposited at an angle to provide shadows that accentuate local topography (Figure 18.17), as described in the previous section on shadow casting. A carbon layer is then deposited on top of the metal layer to cement the patches of metal into a solid surface. Once this cast has been made, the tissue that provided the template can be thawed, removed, and discarded; it is the metal–carbon replica that is placed on the specimen grid and viewed in the electron microscope. Variations in thickness of the metal in different parts of the replica cause variations in the numbers of penetrating electrons to reach the viewing screen, producing the necessary contrast in the image. As discussed in Chapter 4, fracture planes take the path of least resistance through the frozen block, which often carries them through the center of cellular membranes. As a result, this technique is particularly well suited for examining the distribution of integral membrane proteins as they span the lipid bilayer (as in Figures 4.15, 7.30, 7.31, and 7.32). Such studies carried out by Daniel Branton and others played an important role in the formulation of the fluid mosaic structure of cellular membranes in the early 1970s (page 124).
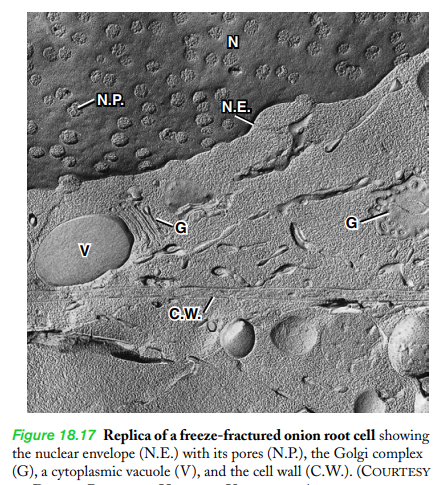
Freeze-fracture replication by itself is an extremely valuable technique, but it can be made even more informative by including a step called freeze etching (Figure 18.16). In this step, the frozen, fractured specimen, while still in place within the cold chamber, is exposed to a vacuum at an elevated temperature for one to a few minutes, during which a layer of ice can evaporate (sublime) from the exposed surface. Once some of the ice has been removed, the surface of the structure can be coated with heavy metal and carbon to create a metallic replica that reveals both the external surface and internal structure of cellular membranes. The development by John Heuser of deep-etching techniques, in which greater amounts of surface ice are removed, led to a fascinating look at cellular organelles. Examples of specimens prepared by this technique are shown in Figures 18.18, 8.38, and 9.46, where it can be seen that the individual parts of the cell stand out in deep relief against the background. The technique delivers very high resolution and can be used to reveal the structure and the distribution of macromolecular complexes, such as those of the cytoskeleton, as they are presumed to exist within the living cell.
동결 골절 복제는 그 자체로 매우 가치 있는 기술이지만 동결 에칭(그림 18.16)이라는 단계를 포함하면 훨씬 더 많은 정보를 얻을 수 있습니다. 이 단계에서 동결되고 파손된 시편은 냉각실 내에 그대로 있는 동안 1분에서 몇 분 동안 상승된 온도의 진공에 노출되며, 그 동안 노출된 표면에서 얼음 층이 증발(숭고)할 수 있습니다. . 얼음의 일부가 제거되면 구조의 표면을 중금속과 탄소로 코팅하여 세포막의 외부 표면과 내부 구조를 모두 드러내는 금속 복제물을 만들 수 있습니다. 더 많은 양의 표면 얼음을 제거하는 깊은 에칭 기술의 John Heuser의 개발은 세포 소기관에 대한 매혹적인 모습으로 이어졌습니다. 이 기술로 준비된 표본의 예는 그림 18.18, 8.38 및 9.46에 나와 있으며, 여기서 세포의 개별 부분이 배경에 대해 깊은 양각으로 눈에 띄는 것을 볼 수 있습니다. 이 기술은 매우 높은 해상도를 제공하며 세포 골격과 같은 거대 분자 복합체의 구조와 분포를 밝히는 데 사용할 수 있습니다.
주사(스캐닝) 전자 현미경microscopía electrónica de barrido
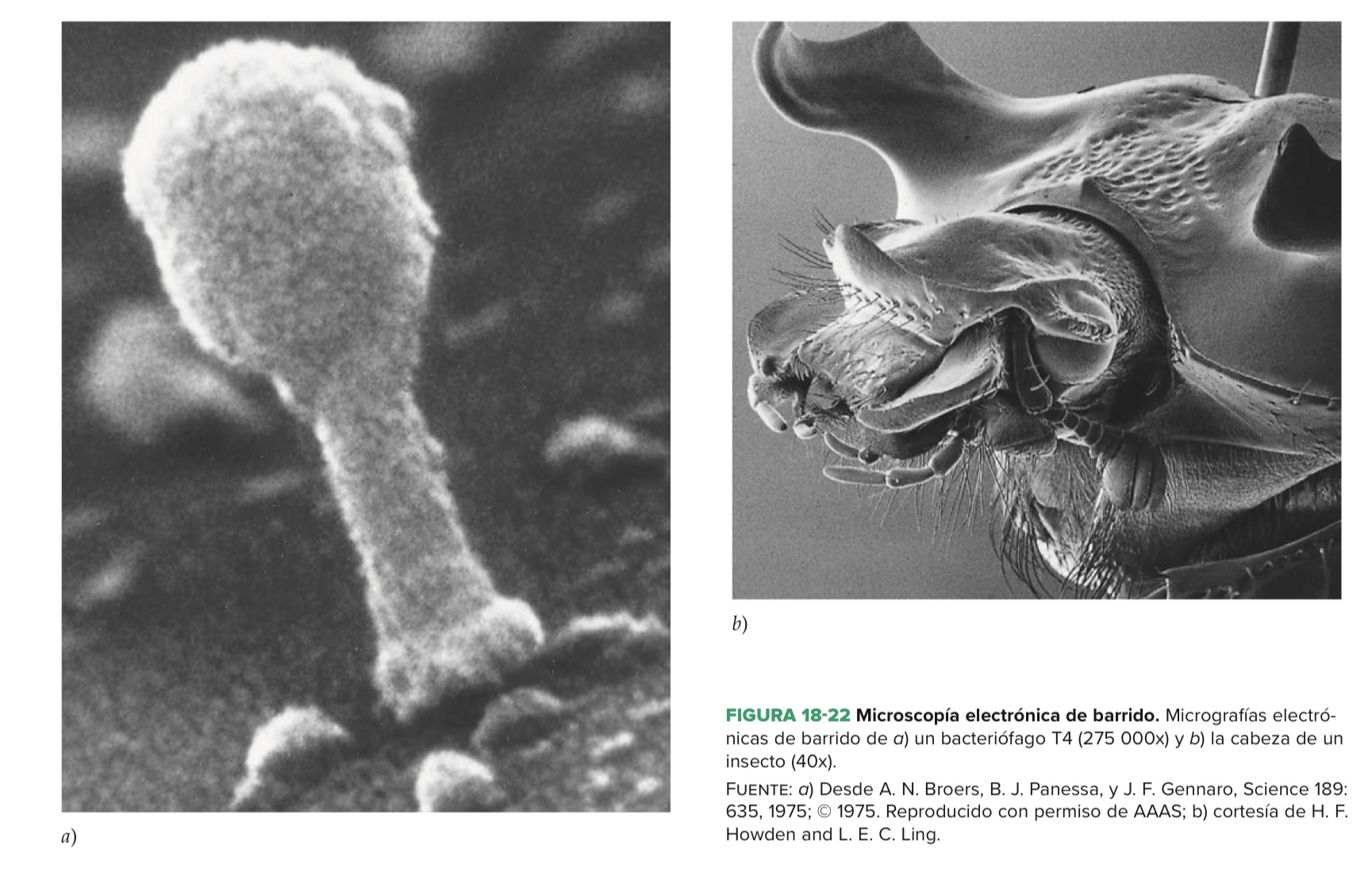
- 물체의 모든면을 조사함!
- 시료 크기제한: 응 바이러스부터 작은거~ 동물머리까지!
- TEM 이랑은 완전 다른 구조construccion, 기능funcionamiento를 지닌당
- 주사전자현미경 시료준비:
- 살아있는 물체의 형태/표면과 동일한 특성을 가지기 위한 과정임!
- but. 액체는 없어야된당 ( 시료를 진공상태로 유지시켜야하기 때문)
* 물: 생세포의 많은 비율을 차지, 모든 거대분자와 연결되므로 제거extraccion하면 세포구조를 파괴한다
⇀ 세포를 공기건조함: 구조파괴가 주로 공기-물 계면interfase의 표면장력tension superficial으로 인해 발생함.
임계점 건조법secado de punto critico
- SEM에 이용될 시료: 알코올에 통과시킨다음 임계점건조법을 이용해서 고정시킨다!
전자현미경 시료가 변형되지 않도록 건조시키기 위해 개발한 방법. 현재는 주로 주사[형]전자현미경 시료제작에 응용되고 있다. 주로 생물시료 건조시 액체의 표면장력으로 생기는 시료의 변형을 방지하기 위해 표면장력이 작용하지 않는 임계점(기체도 액체도 아닌 상태)에서 건조시키는 방법이다. 기체는 일정 온도(임계온도) 이상에서는 아무리 압축하더라도 액화되지 않는다.
| 임계점 건조법을 이용한 SEM의 이용 |
|
| 1. 검사하려는 시료를 고정함 | |
| ⇀ 표면장력이 구조를 변형distorsionar 할 수 없는 압력에서 기화se evaporar 된당! 즉, 표면장력이 구조에 영향을 끼치지 않도록 온도랑 압력을 조절해서 건조시킨다는 말 | 2. 알코올을 통과(아마 탈수)한다음 임계점건조법secado de punto critico을 거쳐 건조시킨당.
|
| 3. 건조된 시료는 얇은 금속막으로 증착되는데, 이게 전자선에 맞는 백색광으로 변하게된다! |
|
| +) 주사전자 현미경의 이미지 형성은 간접적indirecta이다! TEM: 전자가 시료를 통과해서 이미지를 형성 SEM: 시료에서 반사된 전자로 이미지를 형성! or 2차 전자: 1차전자선에서 부딪힌 시료가 내보낸 전자를 통해 이미지 형성 (전자는 시료표면 근처에 위치한 검출기detector이랑 부딪히게됨!) |
|
투과전자 현미경과 주사전자 현미경의 비교!
| TEM 투과전자현미경 | SEM 주사전자현미경 | |
| 전자선haz de electrones | 콘덴서lente de condensador를 통해 모여진 전자선이 campo de vision을 밝힘 | 얇은 레이저가 시료"표면"을 스캔escanea한다고 생각하면 됨! |
| 이미지 형성 | 전자가 시료를 통과해서 이미지를 형성 | 간접적indirecta이다!1. 시료에서 반사된 전자로 이미지를 형성! 2. 2차 전자: 1차전자선에서 부딪힌 시료가 내보낸 전자를 통해 이미지 형성 - retrodispersado (전자는 시료표면 근처에 위치한 검출기detector이랑 부딪히게됨!) ⇀시료표면을 전자선이 스캔하는 동안, 동시에 캐소드관tubo catodo 의 한 면을 다른 전자선이 스캔한다! (ex. 텔레비전의 화면처럼 이미지를 생성하는 것!) 3. 시료에서 전자가 튕겨나가고, 검출기에 도달하면 캐소드관의 전자선력을 검출기에서 조절한당. ⇀ 더 많은 전자가 시료에 도달할 수록, 화면pantalla에 더 강한 신호단위unidad가 도달하고, 광선의 세기가 증폭함 |
| 확대범위:일반 광학현미경? 보다 15에서 150 000배정도 확대 가능 해상도: 전자선의 지름과 연결되어있다. +) 요즘에는 5nm 보다도 적은 해상력을 가질 수 있음! (세포내 표면에 금으로 표지된 항체를 위치하게 할떄 이용 가능하당) 포커스도 잘맞춤enfoque: 광학 현미경보다 약 500배 이상 ⇀ 3D 퀄리티의 이미지 제공 |
||
| 사용 | 세포 표면외의 구조, 여러가지 프로세스, 그 이상의 연결된 것들extensiones, 세포환경ambiente 와 상호작용하는 세포외 물질을 관찰할때 주로 사용된다! |
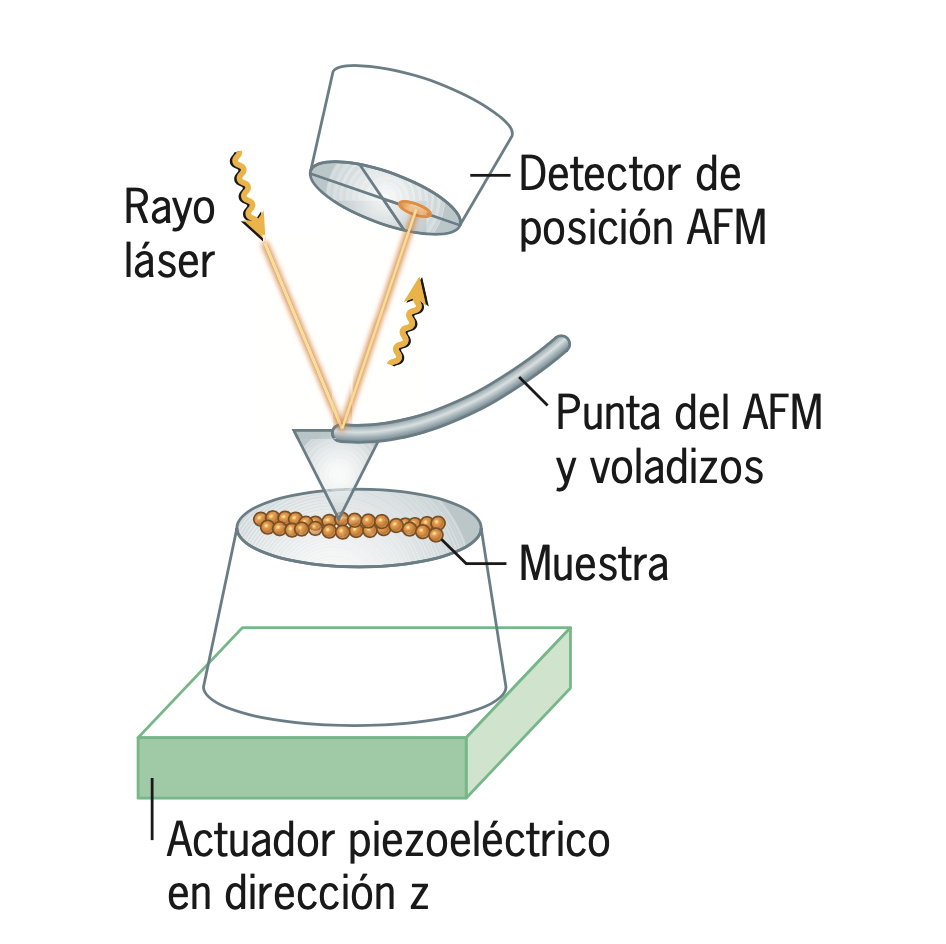
18.7 원자력 현미경microscopia de fuerza atomica
- 스캔형 현미경
- 높은 해상력으로 나노기술과 분자생물할에서 매우 중요히 쓰인당
- 미세하게 작고 날카로운microscópica y afilada탐침sonda을 이용해서 시료 표면을 스캔escanear함
| 기술에 대한 자세한 설명 | 일부 AFM은 탐침이 아주 작은 진동선haz oscilante, voladizo으로 이루어져서, 이 진동선이 시료의 표면에 따라 다른 진동주기를 가지게 됨. 이렇게 변화한 진동선을 통해서 시료 표면의 3차원 이미지를 형성함! |
|
| 이 기술의 특이점 (다른 기술과의 비교) | X 선 결정학이나 crio-EM |
|
 |
AFM |
|
'UNA MED 현역 2021 > 생물(BIOLOGIA)' 카테고리의 다른 글
| [biologia] cap. 1 Introduction to the Study of Cell and Molecular Biology 세포학과 분자생물학의 입문 (0) | 2022.02.25 |
|---|---|
| [biologia] global 공부 (0) | 2021.12.29 |
| [Biologia] cap. 7 복습 (0) | 2021.12.20 |
| [biologia] cap. 9 citoesqueleto 복습 (0) | 2021.12.12 |
| [biologia] capitulo 8 sistema membrana citoplasmica (0) | 2021.12.06 |



댓글