guia 2
라디칼 부언설명
자유 라디칼(Free radical)
▶ 자유 라디칼(Free radical) 이란? 유리기, 라디칼이라고도 한다. 모통의 분자에서는...
blog.naver.com
결합 해체의 종류Tipos de ruptura
| tipos de ruptura | |
 |
 |
| homolitica 동질성 대칭적으로 해체되는 반응으로, 라디칼을 생성한다 ruptura simetrica; se originan radicales |
heterolitica 이종 용해성? ruptura asimetrica; se originan iones 비대칭적 분해로, 이온을 생성한다 탄소양이온, 탄소 음이온 생성 가능 |
반응 중간체(Reaction intermediate)
반응 중간체(reaction intermediate) 또는 중간체(intermediate)는 짧은 시간에 강한 에너지를 내며, 반응...
blog.naver.com
탄소중간체의 종류 intermedios carbonados
- 반응 중간체intermadiario : 반응물에서 생성물로 변환되는 과정 중에 관찰되는 반응성이 큰 물질
- 매우 불안정한 구조이다!
- 옥텟규칙을 만족하지 않음NO tiene el octeto completo
- 전하를 가지고 있음 tiene carga electrica
어떻게 안정화 되는지를 관찰하는 것이 이 단원의 관건!
| carbocation 탄소 양이온 |
Radical carbono o Radical libre 자유 라디칼 |
Carbonion 탄소 음이온 |
Carbeno |
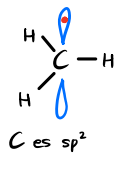
| - 최외각 껍질에 7개의 전자가 존재 sp2 탄소 전자하나가 부족하다 deficit |
-최외각 껍질에 6개의 전자가 존재 - sp2 탄소 - 전자가 부족하다 |
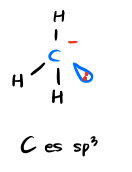
- 8개의 최외각 전자 - 탄소 sp3 - 전자 수 초과 exceso de e |
- 6개의 최외각 전자 - 탄소 sp2 |
| 전자 기부자dadores de electrones 를 통해 안정화 된다 | 전자 끌림기atractores de electrones 를 통해 안정화 된다 | ||
 |
 |
 |
 |
intermedios o Intermediarios
| Carbocation | Radical Carbono o Radical libre |
Carbonion | Carbeno |
 |
 |
 |
 |
| C es sp2 G. electr. = Trigonal plana 3 enlaces 1 orbital "p" = Vacio 6e en CV Tiene deficit de e se estabiliza mediante grupos dadores de e |
C es sp2 G. electr. = Trigonal plana 3 enlaces 1 orbital "p" = 1e 7e en CV Tiene deficit de e se estabiliza mediante grupos dadores de e |
C es sp3 G. electr. = Tetraedrica 3 enlaces 1 orbital "sp3" = 1 par libre 8e en CV Tiene exceso de e se estabiliza mediante grupos atractores de e |
C es sp2 G. electr. = Trigonal plana 2 enlaces 1 orbital "sp2" = 1 par libre 1 orbital "p" = vacio 6e en CV se estabiliza mediante grupos atractores de e |
공명효과, 메소메리효과, 유도효과, 전자성효과
■ 공명효과 공명 효과(Resonance effect) : 분자의 홑전자쌍(고립전자쌍)과 인접한 π결합전자쌍간의 상...
blog.naver.com
중간체를 안정화 하는 방법Formas de estabilizar a los INTERMEDIOS
| 1)유도효과 Efecto Inductivo (I) : 전기음성도에 의한 전자밀도 분포에 차이가 나타나는 효과 transmision de densidad electronica a traves de enlaces sigmas (σ) 시그마 결합을 통해 전자밀도를 전달한다 |
positivo ( I+ ) => grupos dadores de e | |
| negativo ( I- ) => grupos atractores de e | ||
| 2)유도효과 Efecto Inductivo (M) : 분자의 서로 다른 치환기나 작용기간의 상호작용. 치환체와의 전자를 주고 받는 과정. 분자의 극성을 유발하지는 않는다. p오비탈에 파이(π)전자의 재배치이다. 즉, 공명으로 인한 치환체간의 전자의 기부(방출,주다)와 회수(철수,받다)이다. 영구적인 효과이다. 양의 메소메리(+M)와 음의 메소메리(-M)가 있다. 전자의 방출은 +M(양) 그룹이며, 전자의 회수는 -M(음) 그룹이다. Dador o atractor de e basado en resonancia, osea, a traves de enlaces Pi (π) 공명(즉, 파이결합)을 통한 전자 기부기, 전자끌림기 |
positivo ( M+ ) => grupos dadores de e | |
| negativo ( M- ) => grupos atractores de e | ||
공명효과, 메소메리효과, 유도효과, 전자성효과
■ 공명효과 공명 효과(Resonance effect) : 분자의 홑전자쌍(고립전자쌍)과 인접한 π결합전자쌍간의 상...
blog.naver.com
Efecto inductivo (+)
grupos dadores de e => R= grupo alquilo (-CH3, -CH2CH3, -CH2CH2CH3, etc)
 |
|||
| carbocation |  |
||
| radical libre |  |
||
| carbanion |  |
||
Efecto inductivo (-)
grupos atractores de e por alta EN => -F, -Cl, -Br, -OH, etc (alta electronegativo를 가진 그룹으로 이루어졌음!)

cloro atrae (por diferencia de electronegatividad) atrae densidad electrica hacia el!
mas electronegativo sea el atomo, mas se va a ESTABILIZAR! (F가 가장 전기 음성도가 높으므로, Cl이나 Br보다 더 안정화가 일어날 것이다)
Efecto Mesomerico (+) 메소메릭 효과
Estabiliza carbocationes y radicales libres mediante enlaces π o pares libres que estan en el atomo adyacente al C+ o C+ o C• (por resonancia)
공명을 통해 원자 옆에 있는 탄소양이온이나 자유라디칼을 파이결합 (또는 자유전자쌍)을 이용하여 안정화한다

Efecto Mesomerico (-)
Estabiliza carbaniones mediante enlaces π, y es mayor si el grupo atractor de e tiene atomo muy EN! (electronegativo; 전기음성도)
탄소음이온을 파이결합을 통해 안정화함, 전자끌림기의 원자 전기음성도가 높을수록 더 안정화 된당!


반응물 Reactivos
| nucleofilos (Nu) 친핵체 |
electrofilos (E+) 친전자체 |
 |
 |
| - exceso de e - ej : aniones o moleculas neutras cuyo atomo central tiene par libre para dar. - son bases de Lewis |
- deficit de e - ej : cationes o moleculas neutras cuyo atomo central NO tiene el octecto completo - son acidos de Lewis |
유기반응의 종류 Tipos de Reacciones Organicas
| 유기반응의 종류 Tipos de Reacciones Organicas |
|
1) 치환반응reaccion de sustitucion: |
 |
2)첨가반응 reaccion de adicion: 덜 포화된 것이 포화되는 것 즉, 이중결합을 단일결합으로 만들어준다! |
a) 수소화반응 hidrogenacion b) 수화반응 hidratacion  |
3) 제거반응 reaccion de eliminacion: 포화상태였던 반응물이 불포화생성물로 변하는 것 |
a) deshidrogenacion 탈수소화 반응 b) deshidratacion 탈수화반응 |
4) 산화-환원반응 reaccion. REDOX: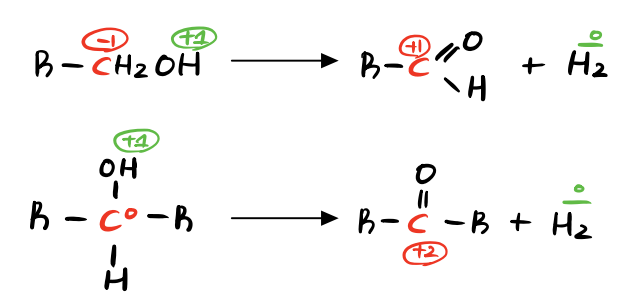 |
|
5) 산- 염기 반응 reaccion. Acido- Base: |
|
6) 중합 반응 reaccion de Polimerizacion: |
단량체가 중합체로 변함! |
ejercicios 풀기!
GUIA 3 Hidrocarburos
| Hidrocarburos alifáticos | Hidrocarburos aromáticos |
 |
 |
Alcanos 알켄
Fórmula General: CnH2n + 2 ( n = 1, 2, 3… )

Nomenclatura:


같은 위치에 다른 sustituyente가 위치하고 있을때는 알파벳 순으로 우선권을 정한다
->etil의 e 가 metil의 m 보다 알파벳 순이 빠르므로 C principal을 세는 순서는 e 가 더 빠른 번호가 되도록 왼쪽부터 카운트 함!

sustituyente가 다른 위치에 여러개 존재하는 경우-> di, tri tetra를 붙인다!
Grupo alquilos

isomeria de ALCANOS
-Isomeria de cadena
-Isomeria conformacional

propiedad fisicas 물리적 특성
- Son compuestos apolares e hidrofóbicos. 극성 및 소수성 화합물
- Sus moléculas interaccionan entre sí mediante fuerzas de dispersión. 분자끼리 분산력을 통해 서로 상호 작용한다
- A medida que aumenta el número de carbonos, aumentan las fuerzas de interacción entre las moléculas y resulta más difícil separarlas. 탄소의 수가 증가할수록 분자 사이의 상호작용력이 증가하여 이들을 분리하기가 더 어려워진다=> Esto da lugar a un aumento en los puntos de fusión y ebullición. 녹는점과 끓는점이 높아짐!
- C1 a C4 => gases 기체
- C5 a c17 => liquido 액체
- C18 en adelante => solido 고체
- pto de ebullicion en Isomero 이성질체의 끊는점 => Ramificaciones 가지수가 늘어날수록, 끊는점 은 낮아진다!

orden decreciente de pto de ebullicion (온도 가장 높은 것부터):
I (가지 아예없음,탄소수 많을수록 끊는점도 상승! ) > II > III
propiedad quimicas 화학적 특성
- Se caracterizan por su inercia química: no reaccionan con ácido ni bases, tampoco con electrófilos ni nucleófilos.화학적 불활성이 특징. 산이나 염기, 친전자체 또는 친핵체와 반응하지 않는다.
- Solo reaccionan con compuestos muy reactivos como los radicales (de halógenos) y el oxígeno. 오직 (할로겐) 라디칼, 산소와 같은 반응성이 높은 화합물과 반응합니다.

a) halogenacion 할로겐화
sustitución radicalaria 라디칼 치환 (유리기 치환 반응)
유리기 치환 반응 - 위키백과, 우리 모두의 백과사전
유리기 치환 반응(Radical substitution 또는 free radical substitution)은 유리기(free radicals)가 반응성 중간체(reactive intermediate)로 참여하는 치환 반응이다. 이 반응은 최소 2단계로 구성되며 3단계도 가능하
ko.wikipedia.org

첫번째 단계) 개시단계(initiation): 유리기의 균형 분해(homolysis)로 생성된다. 균형 분해는 열이나 자외선에 의해 일어나지만 유리기 개시자(radical iiitiator) 역시 반응을 일으킨다

두번째 단계) 전파단계(propagation): 생성된 라디컬이 추가로 라디컬을 계속 만들어 반응이 계속 일어날 수 있게 해주는 단계

마지막 단계) 종결단계(termination)로 : 유리기가 다른 유리기와 결합하는 단계. se agotan los radicales libres 자유 유리기가 모두 소진된다.

monocloracion de ALCANOS de mayor PM (높은 PM의 알칸 일염소화)
알칸의 할로겐화 생성물을 예측하려면 알킬 라디칼의 안정성을 고려해야 한다


ORDEN DE REACTIVIDAD DE H:
H3>H1>H2

B) REACCION DE COMBUSTION (연소 반응):
연소" 분자의 탄소 원자가 산소와 결합하여 이산화탄소 분자가 되고 수소 원자가 물이 되는 유기 분자의 과정.
연소는 발열 반응이며 발산되는 열을 연소열이라고 한다!

A mayor n mayor calor de combustión ->mayor número de átomos de C e H que se van a quemar
n이 높을수록 연소열이 높아짐-> 더 많은 수의 C 및 H 원자를 태워야 함!

ejercicios) Cual es el alcano que origina 14 moles de H2O cuando 2 moles del mismo son sometidos a combustion?
연습문제) 2몰의 H2O가 연소될 때 14몰의 H2O를 생성하는 알칸은 무엇입니까?

풀이) 2n+2=14
2n=12 -> n=6 (n: 탄소의 수)
H6H14 => hexano!
Cicloalcanos
Fórmula General: CnH2n ( n = número de átomos de C en la molécula)
nomenclatura
| nomenclatura | ejemplos |
| no sustituido (ciclohexano: no tiene tension anular porque presenta conformeros 순응성을 나타내므로 고리 장력이 없다!) |
 |
| monosustituido: Si R tiene igual o menos at. C que el ciclo => alquil cicloalcano 유리기가 고리보다 같거나 적은 수의 탄소를 가질 때 |
 |
| monosustituido: Si R tiene mas at. C que el ciclo => ciclo alquil alcano 유리기가 고리보다 많은 수의 탄소를 가질 때 |
 |
'UNA MED 현역 2021 > 화학(QUIMICA)' 카테고리의 다른 글
| [Quimica] GUIA 6 내용 대충 정리 (0) | 2021.09.22 |
|---|---|
| [QUIMICA] guia 4,5 대에에에충 정리 (0) | 2021.09.20 |
| [Quimica] Organica 유기화학 1 단원 ( GUIA 1) (0) | 2021.09.02 |
| [Quimica] guia 19/20 열역학 (0) | 2021.08.23 |
| [semanal 28] 화학; 산염기 (guia 16,17,18) (0) | 2021.08.08 |


댓글