주기율표에 따른 화학 원소 구별Clasificacion Periodica de los elementos quimicos
- elementos REPRESENTATIVOS
Terminan su configuracion electrica en "S" o en "P" de C.V (capa de valencia)
N grupo= N electrones de valencia
Grupos: 1A al 7A
- elementos de Transicion
Terminan su configuracion electrica en "d" de penultima capa
N grupo= suma de e de valencia+ e del subnivel "d"
Grupos: 3B al 8B y 1B
- elementos de Transicion Interna
Terminan su configuracion electrica en "f" de ante penultima capa
6 주기: serie de los LANTANIDOS o METALES de tierras raras
58Ce-----71 Lu
7 주기: serie de los ANTINIDOS o METALES de tierras raras
90Th-----103 Lr
grupo: 3B
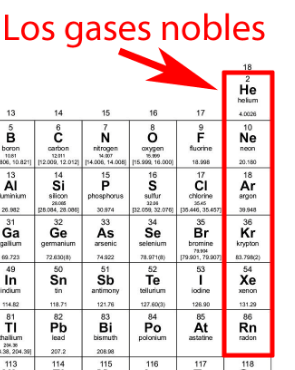
- 비활성 기체gases nobles
Terminan su configuracion electrica en "P^6"
grupo: 8A
화학 결합Enlace Quimica
화학 결합이란? 파이 결합과 시그마 결합에 대하여.
화학이라 하면 누구나 기본 소양으로 이러한 단어들 정도는 들어봤을 것이다. 탄소, 수소, 산소, 질소. 그 ...
blog.naver.com
[고등학교 고급 화학] 원자가결합이론(Valence Bond Theory; VBT)과 혼성오비탈(Hybrid Orbital)
(주의)지금부터 이어지는 내용은 마지막에 언급한 자료들을 토대로 원자가 결합 이론과 혼성오비탈에 관해 ...
blog.naver.com
. 혼합hibridacion
mezcla de O.A (de un mismo atomo) -------(para originar)---> O. hibridos ( energia)
Directamente relacionada con:
-regiones de elevada densidad electronica (r.d.e)
-geometria electronica
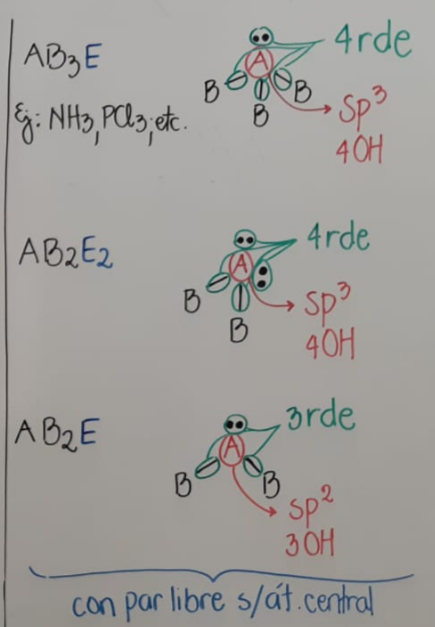
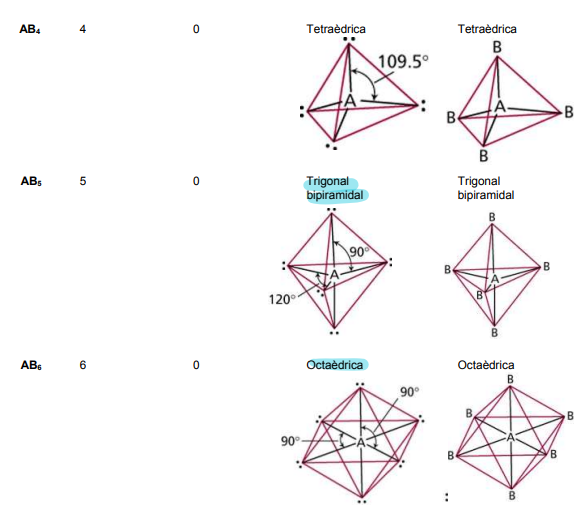
N- r de = n OH atomo central
- 2rde => 2 OH "sp"
- 3rde => 3 OH "sp2"
- 4rde => 4 OH "sp3"


공유결합enlace covalente
-시그마sigma (σ)
오비탈이 정면으로 접근하여 직접적으로 겹칠 때 형성되는 것 superposicion FRONTAL de 2 O.A (원자 오비탈)
- 전자가 두 원자핵 사이에 밀집되므로 서로 다른 원자 사이에 한 개 이상 일어날 수 없다.
- 만약 이중이나 삼중 결합이 형성되어 있다면 그 중 하나만 시그마 결합이고 나머지는 파이 결합이다
예시:
S-S
S-Px
Px-Px
s-hibrido
Px- hibrido
hibrido- hibrido
ex) BF3에서!
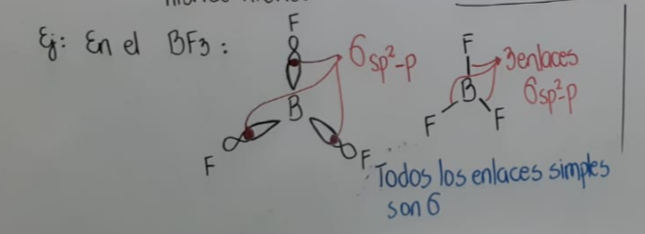
σsp2-p 결합 3개
모든 단일결합은 σ시그마결합이다!
-파이결합Pi (π)
오비탈이 옆면으로 접근하여 직접적으로 겹칠 때 형성되는 것 superposicion LATERAL de 2 OA (원자 오비탈)
- 원자핵으로부터 거리가 멀기 때문에 시그마 결합에 비해 결합력이 약하고, 에너지 준위가 높다.
- 만약 이중이나 삼중 결합이 형성되어 있다면 그 중 하나만 시그마 결합이고 나머지는 파이 결합이다.
예시:
Pz-Pz
Py-Py
ex) 에틸렌C2H4
- 탄소-탄소가 이중결합으로 연결됨
- 약한 파이 결합을 끊고 반응이 일어날 수 있음
=> 분자 내에 파이 결합을 가지고 있으면 그 분자는 반응성이 크다고 볼 수 있으며 두 원자 사이에서 최대 두 개까지 형성될 수 있다

분자내 힘Fuerzas intermoleculares
1) 쌍극자-쌍극자dipolo-dipolo
극성 분자끼리!
ex)
HCl y HCl
SO2 y H2S
끊는점이 높으면=> 쌍극자-쌍극자 힘도 증가=> 쌍극자모먼트μ(뮤) 도 증가!
nitrilo CH3CN
알데하이드 CH3CH=O
에터 CH3-O-CH3
를 비교하면...
CH3CN (nitrilo)> CH3CH=O (알데하이드)>CH3-O-CH3 (에터)
<<<<<극성증가, 끊는점 높아짐!<<<<<<<<<<<<<<<<<<<<
2) 수소결합puentes de hidrogeno

3) 런던 분산력fuerzas de dispersion de London
- 극성분자들끼리도, 무극성분자들끼리도, 극성/무극성 원자들끼리에도 존재하는 결합
- 어떻게 무극성 분자들끼리 결합할 수 있는지를 설명하는 유일한 결합이당!
PM(분자무게)나 크기가 증가하면=> 극성polarizabilidad도 증가하고=> 런던분산력도 증가하고=> 끊는점도 증가한당!

4) 쌍극자-유도쌍극자dipolo-dipolo inducido
- 유도쌍극자=> 무극성분자!
- 극성분자와 무극성 분자간의 힘이당.

NOMENCLATURA 명명법
- combinaciones
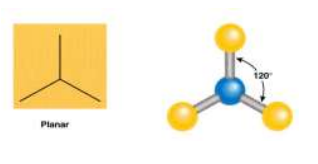
| Binarias | oxigenadas | oxidos basicos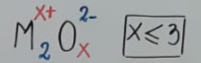 |
oxidos acidos 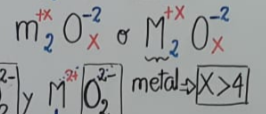 |
||
peroxidos |
||
superoxidos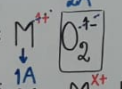 |
||
| hidrogenados | hidruros metalicos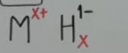 |
|
hidruros no metalicos |
||
| no oxigenadas ni hidrogendas | sal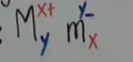 |
|
compuestos binarios covalentes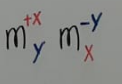 |
||
| Ternarias | acidos oxacidos: anhidrido + H2O | |
| hidroxidos: oxido basico + H2O | ||
| sales |
-6
-7
-9 (Ecuaciones)
estequiometria para siguiente semana (8,10)
'UNA MED 현역 2021 > 화학(QUIMICA)' 카테고리의 다른 글
| [quimica] 전체복습, 기억할 부분 (0) | 2022.02.11 |
|---|---|
| [화학] 전기화학electroquimica (0) | 2022.01.24 |
| [Quimica] Estequiometria de la composicion 화학양론 (복습!) (0) | 2021.12.22 |
| [quimica] 유기화학 11. 지질 lipidos (0) | 2021.11.23 |
| [Quimica] GUIA 6 내용 대충 정리 (0) | 2021.09.22 |



댓글